2 Đề ôn học kì II Hóa học 10
Bạn đang xem tài liệu "2 Đề ôn học kì II Hóa học 10", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: 2 Đề ôn học kì II Hóa học 10
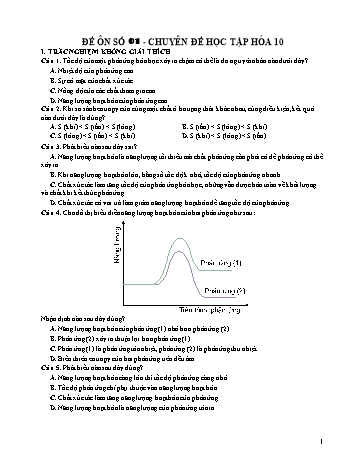
ĐỀ ÔN SỐ 01 - CHUYÊN ĐỀ HỌC TẬP HÓA 10 I. TRẮC NGHIỆM KHÔNG GIẢI THÍCH Câu 1. Tốc độ của một phản ứng hóa học xảy ra chậm có thể là do nguyên nhân nào dưới đây? A. Nhiệt độ của phản ứng cao. B. Sự có mặt của chất xúc tác. C. Nồng độ của các chất tham gia cao. D. Năng lượng hoạt hóa của phản ứng cao. Câu 2. Khi so sánh entropy của cùng một chất ở ba trạng thái khác nhau, cùng điều kiện, kết quả nào dưới đây là đúng? A. S (khí) < S (rắn) < S (lỏng). B. S (rắn) < S (lỏng) < S (khí). C. S (lỏng) < S (rắn) < S (khí). D. S (khí) < S (lỏng) < S (rắn). Câu 3. Phát biểu nào sau đây sai? A. Năng lượng hoạt hóa là năng lượng tối thiểu mà chất phản ứng cần phải có để phản ứng có thể xảy ra. B. Khi năng lượng hoạt hóa lớn, hằng số tốc độ k nhỏ, tốc độ của phản ứng nhanh. C. Chất xúc tác làm tăng tốc độ của phản ứng hóa học, những vẫn được bảo toàn về khối lượng và chất khi kết thúc phản ứng. D. Chất xúc tác có vai trò làm giảm năng lượng hoạt hóa để tăng tốc độ của phản ứng. Câu 4. Cho đồ thị biểu diễn năng lượng hoạt hóa của hai phản ứng như sau: Nhận định nào sau đây đúng? A. Năng lượng hoạt hóa của phản ứng (1) nhỏ hơn phản ứng (2). B. Phản ứng (2) xảy ra thuận lợi hơn phản ứng (1). C. Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng (2) là phản ứng thu nhiệt. D. Biến thiên entropy của hai phản ứng trên đều âm. Câu 5. Phát biểu nào sau đây đúng? A. Năng lượng hoạt hóa càng lớn thì tốc độ phản ứng càng nhỏ. B. Tốc độ phản ứng chỉ phụ thuộc vào năng lượng hoạt hóa. C. Chất xúc tác làm tăng năng lượng hoạt hóa của phản ứng. D. Năng lượng hoạt hóa là năng lượng của phản ứng tỏa ra. 1 Câu 6. Phương pháp nào sau đây được sử dụng để làm giảm năng lượng hoạt hóa của phản ứng hóa học? A. Tăng nhiệt độ của hệ phản ứng. B. Tăng diện tích bề mặt chất tham gia. C. Giảm nồng độ của các chất tham gia. D. Thêm xúc tác vào hệ phản ứng. Câu 7. Đặc điểm nào sau đây không phải của chất xúc tác? A. Làm giảm năng lượng hoạt hóaB. Làm tăng tốc độ phản ứng C. Có tính định hướng, chọn lọcD. Biến đổi về lượng và chất sau phản ứng Câu 8. Đại lượng đặc trưng cho độ mất trật tự của một hệ ở trạng thái và điều kiện xác định gọi là A. Enthalpy. B. Năng lượng tự do Gibbs. C. Entropy. D. Năng lượng hoạt hóa. Câu 9. Hydrogen phản ứng với nitrogen tạo thành ammonia (NH3) theo phương trình sau: 0 0 3H2 (g) + N2 (g) → 2NH3 (g) có H298 = -92,38 kJ/mol; S298 = -198,2 J/mol.K. Biến thiên năng lượng tự do Gibbs của phản ứng trên ở 25℃ là? A. 5897 kJ/mol. B. 297,8 kJ/mol. C. -33,32 kJ/mol. D. -16,66 kJ/mol. Câu 10. Hằng số tốc độ của một phản ứng ở 500°C và 750°C lần lượt là 0,113 s-1 và 0,150 s-1. Năng lượng hoạt hóa của phản ứng này là A. 7,44 kJ/mol. B. 14,4 kJ/mol. C. 57,6 kJ/mol. D. 115,2 II. TỰ LUẬN Bài 1: Cho giản đồ năng lượng của các phản ứng: (a) (b) (c) a) Hãy biểu diễn năng lượng hoạt hóa trên giản đồ năng lượng của phản ứng trong từng trường hợp (vẽ trên hình b) Giản đồ năng lượng nào biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng? 2 Bài 2: Một phản ứng xảy ra ở nhiệt độ không đổi là 25°C, năng lượng hoạt hóa của phản ứng khi không có xúc tác là 100 kJ/mol và khi có xúc tác 50 kJ/mol. So sánh tốc độ của phản ứng trong hai trường hợp này. Bài 3: Phản ứng tổng hợp SO3 trong dây chuyền sản xuất sulfuric acid: 2SO2 (g) + O2 (g) → 2SO3 (g) Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 350°C lên 450°C. Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol. Bài 4: Cho phản ứng hóa học: CO2 (g) → CO (g) + ½ O2 (g) và các dữ kiện: Chất O2 (g) CO2 (g) CO (g) o f H298 (kJ / mol) 0 - 393,51 - 110,05 o S298 (J / mol K) 205,03 213,69 197,50 a Ở điều kiện chuẩn phản ứng trên có tự xảy ra được không ? o o b Nếu coi r H và r S không phụ thuộc vào nhiệt độ, hãy cho biết ở nhiệt độ nào phản ứng trên có thể tự xảy ra ở điều kiện chuẩn? 3 ĐỀ ÔN SỐ 02 - CHUYÊN ĐỀ HỌC TẬP HÓA 10 I. TRẮC NGHIỆM KHÔNG GIẢI THÍCH Câu 1. Quá trình nào sau đây có biến thiên entropy âm? A. Quá trình ngưng tụ hơi nước thành nước mưa. B. Quá trình nấu chảy sắt thép phế liệu. C. Nước đá tan ra ở nhiệt độ thường. D. Quá trình tiêu hóa thức ăn ở dạ dày. Câu 2. Cho đồ thị biểu diễn năng lượng của một phản ứng như sau: Đoạn nào trên đồ thị tương ứng với năng lượng hoạt hóa của phản ứng? A. Đoạn (A). B. Đoạn (B). C. Đoạn (C). D. Đoạn (D). Câu 3. Dãy nào sau đây các chất sắp xếp theo chiều tăng giá trị entropy chuẩn? A. CO2 (s) < CO2 (l) < CO2 (g). B. CO2 (g) < CO2 (l) < CO2 (s). C. CO2 (s) < CO2 (g) < CO2 (l). D. CO2 (g) < CO2 (s) < CO2 (l). Câu 4. Phản ứng nào dưới đây xảy ra kèm theo sự giảm entropy? A. N2 (g) + O2 (g) → 2NO (g). B. N2O4 (g) → 2NO2 (g). C. 2CO (g) → C (s) + CO2 (g). D. 2HCl (aq) + Fe (s) → FeCl2 (aq) + H2 (g). Câu 5. Cho phản ứng có dạng: A → 2B + C. Biến thiên entropy chuẩn của phản ứng được tính bằng biểu thức nào sau đây? A. S0 (A) - S0 (B) - S0 (C). B. S0 (B) + S0 (C) - S0 (A). C. S0 (A) - 2S0 (B) - S0 (C). D. 2S0 (B) + S0 (C) - S0 (A). Câu 6. Đại lượng nào sau đây được dùng để dự đoán hoặc giải thích chiều của một phản ứng phù hợp nhất ở điều kiện nhiệt độ, áp suất không đổi? A. Biến thiên entropy. B. Biến thiên enthalpy. C. Biến thiên năng lượng tự do Gibbs. D. Năng lượng hoạt hóa. Câu 7. Biến thiên năng lượng tự do Gibbs được tính theo biểu thức nào dưới đây? A. ΔG = TΔH – ΔS. B. ΔG = ΔS – TΔH. C. ΔG = ΔH – TΔS. D. ΔG = TΔS – ΔH. Câu 8. Phát biểu nào sau đây đúng? A. Entropy càng lớn thì hệ càng ổn định. B. Khi tăng nhiệt độ thì entropy của chất tăng. 4 C. Một phản ứng có ΔH 0. D. Entropy của chất lỏng lớn hơn entropy của chất khí. Câu 9. Cho đồ thị biểu diễn năng lượng hoạt hóa của một phản ứng như sau: Năng lượng hoạt hóa của phản ứng trên là A. 10 kJ. B. 45 kJ. C. 108 kJ. D. 58 kJ. Câu 10. Tốc độ của một phản ứng tăng gấp đôi khi tăng nhiệt độ từ 20°C lên 30°C. Năng lượng hoạt hóa của phản ứng này là A. 0,35 kJ/mol. B. 6,2 kJ/mol. C. 22 kJ/mol. D. 51 kJ/mol. II. TỰ LUẬN Bài 1: Một phản ứng xảy ra ở nhiệt độ không đổi là 75°C, năng lượng hoạt hóa của phản ứng khi không có xúc tác là 150 kJ/mol và khi có xúc tác 100 kJ/mol. So sánh tốc độ của phản ứng trong hai trường hợp này. Bài 2: Phản ứng phân hủy N2O5 xảy ra ở 45°C theo phương trình phản ứng: N2O5 (g) → N2O4 (g) + ½ O2 (g) Tốc độ của phản ứng thay đổi thế nào khi tăng nhiệt độ phản ứng lên 65 °C? Biết năng lượng hoạt hóa của phản ứng là 103,5 kJ/mol. 5 Bài 3: Tính năng lượng hoạt hóa của một phản ứng biết rằng khi nhiệt độ tăng từ 300K lên 310K thì tốc độ phản ứng tăng 3 lần. Bài 4: Cho phản ứng hóa học: 2NO (g) + O2 (g) → 2NO2 (g) và các dữ kiện: Chất O2 (g) NO2 (g) NO (g) 0 205,0 239,9 210,7 S298 (J/mol·K) 0 0 33,2 90,3 f H298 (kJ/mol) Ở điều kiện chuẩn và 25℃ phản ứng trên có tự xảy ra được không? ---HẾT--- 6
File đính kèm:
 de_on_hoc_ki_ii_hoa_hoc_10_de_so_0102.docx
de_on_hoc_ki_ii_hoa_hoc_10_de_so_0102.docx

