Đề cương ôn tập cuối học kỳ II Hóa học 10 - Đề minh họa số 1-3 - Năm học 2022-2023 - Trường THPT Sơn Trà
Bạn đang xem tài liệu "Đề cương ôn tập cuối học kỳ II Hóa học 10 - Đề minh họa số 1-3 - Năm học 2022-2023 - Trường THPT Sơn Trà", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập cuối học kỳ II Hóa học 10 - Đề minh họa số 1-3 - Năm học 2022-2023 - Trường THPT Sơn Trà
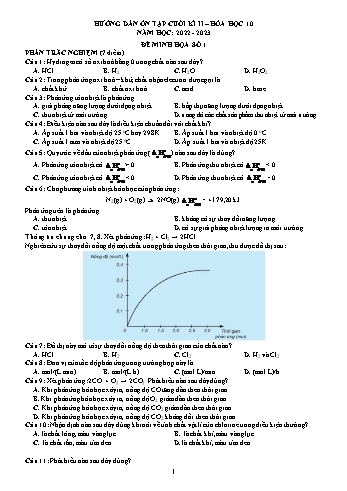
HƯỚNG DẪN ƠN TẬP CUỐI KÌ II – HĨA HỌC 10 NĂM HỌC: 2022 - 2023 ĐỀ MINH HỌA SỐ 1 PHẦN TRẮC NGHIỆM (7 điểm) Câu 1: Hydrogen cĩ số oxi hố bằng 0 trong chất nào sau đây? A. HCl.B. H 2. C. H2O.D. H 2O2. Câu 2: Trong phản ứng oxi hố – khử, chất nhận electron được gọi là A. chất khử.B. chất oxi hố.C. acid.D. base. Câu 3: Phản ứng tỏa nhiệt là phản ứng A. giải phĩng năng lượng dưới dạng nhiệt. B. hấp thụ năng lượng dưới dạng nhiệt. C. thu nhiệt từ mơi trường. D. trong đĩ các chất sản phẩm thu nhiệt từ mơi trường. Câu 4: Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí? A. Áp suất 1 bar và nhiệt độ 25 oC hay 298K.B. Áp suất 1 bar và nhiệt độ 0 oC. C. Áp suất 1 atm và nhiệt độ 25 oC.D. Áp suất 1 bar và nhiệt độ 25K. o Câu 5: Quy ước về dấu của nhiệt phản ứng ( rH298 ) nào sau đây là đúng? o o A. Phản ứng tỏa nhiệt cĩ rH298 > 0.B. Phản ứng thu nhiệt cĩ rH298 < 0. o o C. Phản ứng tỏa nhiệt cĩ rH298 < 0. D. Phản ứng thu nhiệt cĩ rH298 = 0. Câu 6: Cho phương trình nhiệt hĩa học của phản ứng: o N2(g) + O2(g) 2NO(g) = +179,20 kJ. rH298 Phản ứng trên là phản ứng A. thu nhiệt.B. khơng cĩ sự thay đổi năng lượng. C. tỏa nhiệt.D. cĩ sự giải phĩng nhiệt lượng ra mơi trường. Thơng tin chung cho 7, 8. Xét phản ứng: H2 + Cl2 → 2HCl. Nghiên cứu sự thay đổi nồng độ một chất trong phản ứng theo thời gian, thu được đồ thị sau: Câu 7: Đồ thị này mơ tả sự thay đổi nồng độ theo thời gian của chất nào? A. HCl.B. H 2.C. Cl 2. D. H2 và Cl2. Câu 8: Đơn vị của tốc độ phản ứng trong trường hợp này là A. mol/(L.min).B. mol/(L.h).C. (mol.L)/min.D. (mol.L)/h. Câu 9: Xét phản ứng: 2CO + O2 → 2CO2. Phát biểu nào sau đây đúng? A. Khi phản ứng hĩa học xảy ra, nồng độ CO tăng dần theo thời gian. B. Khi phản ứng hĩa học xảy ra, nồng độ O2 giảm dần theo thời gian. C. Khi phản ứng hĩa học xảy ra, nồng độ CO2 giảm dần theo thời gian. D. Khi phản ứng hĩa học xảy ra, nồng độ CO2 khơng đổi theo thời gian. Câu 10: Nhận định nào sau đây đúng khi nĩi về tính chất vật lí của chlorine trong điều kiện thường? A. là chất lỏng, màu vàng lục.B. là chất khí, màu vàng lục. C. là chất rắn, màu tím đen.D. là chất khí, màu tím đen. Câu 11: Phát biểu nào sau đây đúng? 1 A. Giá trị hệ số nhiệt độ Van’t Hoff (γ) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh. B. Giá trị hệ số nhiệt độ Van’t Hoff (γ) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng yếu. C. Nhiệt độ khơng ảnh hưởng đến tốc độ phản ứng. D. Tăng nhiệt độ sẽ làm giảm tốc độ phản ứng. Câu 12: Trong cơ thể người, nguyên tố chlorine cĩ trong máu và dịch vị dạ dày (ở dạng ion Cl -), nguyên tố iodine cĩ ở tuyến giáp (ở dạng hợp chất hữu cơ). Phát biểu nào sau đây là đúng? A. Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất. B. Trong tự nhiên, halogen chủ yếu tồn tại ở dạng hợp chất. C. Trong tự nhiên, halogen chỉ tồn tại ở dạng đơn chất. D. Trong tự nhiên, halogen vừa tồn tại ở dạng hợp chất vừa tồn tại ở dạng đơn chất. Câu 13: “Ở điều kiện thường, các halogen trong nước, tan nhiều trong dung mơi hữu cơ như alcohol, benzene.” Cụm từ cịn thiếu ở dấu “ ” trong phát biểu trên là A. tan nhiều.B. khơng tan.C. ít tan.D. tan rất nhiều. Câu 14: Nước Javen được dùng làm chất tẩy rửa, khử trùng. Phương trình tạo ra nước Javen là A. 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O.B. Cl 2 + 2NaOH → NaCl + NaClO + H2O. C. Cl2 + H2 → 2HCl. D. Cl2 + 2Na → 2NaCl. Câu 15: Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon là A. HCl.B. HI.C. HF.D. HBr. Câu 16: Nhỏ vài giọt dung dịch AgNO3 vào ống nghiệm chứa khoảng 2 mL dung dịch NaCl. Hiện tượng quan sát được là A. cĩ kết tủa màu trắng.B. cĩ kết tủa màu vàng. C. cĩ kết tủa màu vàng nhạt.D. cĩ kết tủa màu tím. - Câu 17: Số oxi hĩa của Carbon trong ion HCO3 là A. +2.B. -2.C. -1. D. +4. Câu 18: Cho quá trình Al → Al3+ + 3e, đây là quá trình A. khử. B. oxi hĩa. C. tự oxi hĩa – khử. D. nhận proton. Câu 19: Cho phương trình nhiệt hĩa học của phản ứng trung hồ sau: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ΔrH = -57,3 kJ Phát biểu nào sau đây khơng đúng? A. Cho 1 mol HCl tác dụng với NaOH dư toả nhiệt lượng là 57,3 kJ. B. Cho HCl dư tác dụng với 1 mol NaOH thu nhiệt lượng là 57,3 kJ. C. Cho 1 mol HCl tác dụng với 1 mol NaOH toả nhiệt lượng là 57,3 kJ. D. Cho 2 mol HCl tác dụng với NaOH dư toả nhiệt lượng là 57,3 kJ. Câu 20: Cho phương trình phản ứng sau: o 2H2(g) + O2(g) 2H2O(l) rH298 = -572 kJ Khi cho 2 gam khí H2 tác dụng hồn tồn với 16 gam khí O2 thì phản ứng A. toả ra nhiệt lượng 286 kJ.B. thu vào nhiệt lượng 286 kJ. C. toả ra nhiệt lượng 572 kJ.D. thu vào nhiệt lượng 572 kJ. Câu 21 Cho quá trình: o o (a) H2O (lỏng, ở 25 C ) H2O (hơi, ở 100 C ), là quá trình thu nhiệt. o o (b) H2O (lỏng, ở 25 C ) H2O (rắn, ở 0 C ), là quá trình tỏa nhiệt. Nung (c) CaCO3 (Đá vơi) CaO CO2. là quá trình thu nhiệt. (d) Khí methane (CH4 ) cháy trong oxygen, là quá trình tỏa nhiệt. Số nhận định đúng là A. 1.B. 2.C. 3.D. 4. Câu 22: Cho một mẫu magnesium (Mg) cĩ khối lượng 4,8 gam vào dung dịch chứa 0,01 mol HCl. Sau khi phản ứng kết thúc, thu được m gam muối chloride. Giá trị của m là (cho nguyên tử khối Mg=24 Cl=35,5) 2 A. 19.B. 0,2975.C. 0,475.D. 0,95. Câu 23: Dãy các đơn chất halogen nào sau đây được xếp theo thứ tự tính oxi hĩa tăng dần? A. F2, Cl2, Br2, I2. B. Cl2, Br2, I2, F2. C. Cl2, F2, Br2, I2. D. I2, Br2, Cl2, F2. Câu 24: Xét phản ứng: Zn + H2SO4 → ZnSO4 + H2. Ban đầu cĩ 0,45 mol zinc (Zn). Sau 50 giây, lượng zinc cịn lại là 0,2 mol. Tốc độ trung bình của phản ứng đĩ trong khoảng thời gian trên là A. 0,005 mol/min.B. 0,009 mol/min.C. 0,004 mol/min.D. 0,013 mol/min. Câu 25: Cho phản ứng hĩa học : A (g) + 2B (g) → AB2 (g). Tốc độ phản ứng sẽ tăng nếu A. Giảm áp suất. B. Tăng thể tích của bình phản ứng. C. Tăng áp suất.D. Giảm nồng độ của chất A. Câu 26: Để điều chế khí chlorine, người ta cho các chất như MnO2 hoặc KMnO4 tác dụng với hydrochloric acid (HCl). Trong các phản ứng này, HCl thể hiện A. là acid khơng cĩ tính khử.B. vừa tính khử vừa tính oxi hĩa. C. tính khử.D. tính oxi hĩa. Câu 27: Dung dịch HF cĩ khả năng ăn mịn thủy tinh là do phản ứng hĩa học nào sau đây? A. KOH + HF → KF + H2O.B. SiO 2 + 4HF → SiF4 + 2H2O. C. F2 + H2 → 2HF.D. 2F 2 + 2H2O → 4HF + O2. Câu 28: Thực hiện 2 thí nghiệm theo hình vẽ sau: Nhận định nào sau đây là đúng? A. Thí nghiệm 1 xảy ra nhanh hơn. B. Thí nghiệm 2 xảy ra nhanh hơn. C. Tốc độ của phản ứng ở hai thí nghiệm bằng nhau. D. Tốc độ phản ứng ở thí nghiệm 2 gấp 2 lần tốc độ phản ứng ở thí nghiệm 1. PHẦN TỰ LUẬN Câu 29 (1,0 điểm): Đốt cháy khí methane CH4 bằng khí oxygen thu được khí carbon dioxide và hơi nước. 0 Biết nhiệt tạo thành chuẩn (Δ fH 298, kJ/mol) của CH4(g), CO2(g) và H2O(g) lần lượt là: –74,9, –393,5, – 285,8. Viết phương trình nhiệt hĩa học của phản ứng đốt cháy trên và cho biết phản ứng tỏa nhiệt hay thu nhiệt. Câu 30 (1,0 điểm): Lập phương trình phản ứng oxi hĩa - khử xảy ra theo phương pháp thăng bằng electron khi thực hiện thí nghiệm cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O. Xác định vai trị các chất tham gia phản ứng. Câu 31 (0,5 điểm): NOCl là chất khí độc, sinh ra do sự phân hủy nước cường toan (hỗn hợp HNO3 và HCl cĩ tỉ lệ 1:3) NOCl cĩ tính oxi hĩa mạnh, ở nhiệt độ cao bị phân hủy theo phản ứng hĩa học sau: 2NOCl → 2NO + Cl2 Tốc độ phản ứng ở 70oC là 2.10-7 mol/(l.s) và ở 80oC là 4,5.10-7 mol/(l.s). a) Tính hệ số nhiệt độ của phản ứng. b) Dự đốn tốc độ phản ứng ở 600C. Câu 32 (0,5 điểm): Làm muối là nghề phổ biến tại nhiều vùng ven biển Việt Nam. Một hộ gia đình tiến hành làm muối trên ruộng chứa 200 000 L nước biển. Giả thiết 1 L nước biển cĩ chứa 30 gam NaCl và hiệu suất quá trình làm muối thành phẩm đạt 60%. Tính khối lượng muối hộ gia đình thu được. 3 ĐỀ MINH HỌA SỐ 2 PHẦN TRẮC NGHIỆM (7 điểm) Câu 1: Số oxi hĩa của nguyên tử S trong hợp chất SO2 là A. +2. B. +4.C. +6.D. 1. Câu 2: Trong phản ứng oxi hố – khử, chất nhường electron được gọi là A. chất khử.B. chất oxi hố.C. acid.D. base. Câu 3: Enthalpy tạo thành chuẩn của một đơn chất bền A. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đĩ với hydrogen. B. là biến thiên enthalpy chuẩn của phản ứng giữa nguyên tố đĩ với oxygen. C. được xác định từ nhiệt độ nĩng chảy của nguyên tố đĩ. D. bằng 0. Câu 4: Điều kiện nào sau đây là điều kiện chuẩn đối với chất khí? A. Áp suất 1 bar và nhiệt độ 25 oC hay 298K.B. Áp suất 1 bar và nhiệt độ 273K. C. Áp suất 1 bar và nhiệt độ 0 oC.D. Áp suất 1 bar và nhiệt độ 25K. Câu 5: Cho phương trình nhiệt hĩa học của phản ứng: o 2H2(g) + O2(g) 2H2O(l) = -571,68kJ rH298 Phản ứng trên là phản ứng A. thu nhiệt. C. khơng cĩ sự thay đổi năng lượng. B. tỏa nhiệt. D. cĩ sự hấp thụ nhiệt lượng từ mơi trường xung quanh. Câu 6: Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng? A. Phản ứng tỏa nhiệt. B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm. C. Biến thiên enthalpy của phản ứng là a kJ/mol. D. Phản ứng thu nhiệt. Câu 7: Phản ứng tỏa nhiệt là phản ứng trong đĩ A. hỗn hợp phản ứng truyền nhiệt cho mơi trường. B. chất phản ứng truyền nhiệt cho sản phẩm. C. chất phản ứng thu nhiệt từ mơi trường D. các chất sản phẩm thu nhiệt từ mơi trường. Câu 8: Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hĩa học xảy ra, tốc độ phản ứng sẽ A. khơng đổi cho đến khi kết thúc. B. tăng dần cho đến khi kết thúc. C. chậm dần cho đến khi kết thúc. D. tuân theo định luật tác dụng khối lượng. Câu 9: Tốc độ phản ứng khơng phụ thuộc yếu tố nào sau đây? A. Thời gian xảy ra phản ứng. B. Bề mặt tiếp xúc giữa các chất phản ứng. C. Nồng độ các chất tham gia phản ứng. D. Chất xúc tác. Câu 10: Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể lỏng? A. F2.B. Cl 2. C. Br2.D. I 2. Câu 11: Đâu là mơ tả đúng về đơn chất halogen F2? A. Thăng hoa khi đun nĩng.B. Dùng để sản xuất nước Javel. C. Oxi hĩa được nước.D. Chất lỏng, màu nâu đỏ. Câu 12: Br2 cĩ thể phản ứng được với muối trong dung dịch nào sau đây? A. NaF.B. NaCl.C. NaBr.D. NaI. Câu 13: Silver halide nào sau đây cĩ màu vàng nhạt? A. AgF.B. AgCl.C. AgBr.D. AgI. Câu 14: Hydrohalic acid cĩ tính acid mạnh nhất là A. HI.B. HCl.C. HBr. D. HF. Câu 15: Hydrochloric acid đặc thể hiện tính khử khi tác dụng với chất nào sau đây? A. NaHCO3. B. CaCO3.C. NaOH. D. MnO 2. 4 Câu 16: Trước đây, các hợp chất CFC được sử dụng cho các hệ thống làm lạnh. Tuy nhiên hiện nay, người ta sản xuất hydrochlorofluorocarbon (HCFC) thay thế CFC. Nguyên nhân là do: A. sản xuất hợp chất CFC rất tốn kém. B. hiệu quả sử dụng của HCFC cao hơn CFC trong các hệ thống làm lạnh. C. CFC dễ gây ngộ độc khi sản xuất. D. CFC làm phá hủy tầng ozone khi xâm nhập vào khí quyển. Câu 17: Phát biểu nào trong các câu sau đây là khơng đúng ? A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất. B. Nước giải khát được nén CO2 vào ở áp suất cao hơn sẽ cĩ độ chua (độ axit) lớn hơn. C. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn. D. Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong khơng khí. Câu 18: Cho 2 mẫu BaSO3 cĩ khối lượng bằng nhau vào 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn? dung dịch HCl 0,1M BaSO3 BaSO3 dạng bột dạng khối .................. ......................... Cốc 1 Cốc 2 A. Cốc 1 tan nhanh hơn.B. Cốc 2 tan nhanh hơn. C. Tốc độ tan ở 2 cốc như nhau.D. BaSO 3 tan nhanh nên khơng quan sát được. Câu 19: Số oxi hĩa của Ca trong Ca, CaSO4 lần lượt là A. 0, +2.B. +2, 0.C. 0, 0.D. +2, +2. Câu 20: Cho phản ứng: 6FeSO4 + K2Cr2O7 + 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O Trong phản ứng trên, chất oxi hĩa và chất khử lần lượt là A. K2Cr2O7 và FeSO4. B. K2Cr2O7 và H2SO4. C. H2SO4 và FeSO4. D. FeSO4 và K2Cr2O7. Câu 21: Cho enthalpy tạo thành chuẩn của một số chất như sau: Chất CaCO3(s) CaO(s) CO2(g) o f H298 (kJ/mol) -1206,90 -635,10 -393,50 Biến thiên enthalpy chuẩn của các phản ứng sau CaCO3(s) CaO(s) + CO2(g) là A. +140 kJ.B. -1120 kJ.C. 178,3 kJ.D. -420 kJ. Câu 22: Dựa vào phương trình nhiệt hĩa học của phản ứng sau: 1 o CO2(g) CO(g) + O2(g) H = +280 kJ 2 r 298 o Giá trị của phản ứng: 2CO2(g) 2CO(g) + O2(g) là rH298 A. +140 kJ.B. -1120 kJ.C. +560 kJ.D. -420 kJ. Câu 23: Khi nhiệt độ tăng thêm 100C, tốc độ phản ứng hố học tăng thêm 2 lần. Nếu ở 250, phản ứng cĩ tốc độ là 0,036 mol/(L.h) thì ở 350C, phản ứng cĩ tốc độ là A. 0,036 mol/(L.h). B. 0,09 mol/(L.h). C. 0,072 mol/(L.h). D. 0,144 mol/(L.h). Câu 24: Cho phản ứng 3O2(g) 2O3(g) Ban đầu nồng độ oxygen là 0,024 mol/lít. Sau 5s thì nồng độ của oxygen là 0,02 mol/lít. Tốc tốc độ trung bình của phản ứng trên theo oxygen là bao nhiêu mol/(L.min)? A. 2,67.10-3. B. 2,67.10-4. C. 8.10-4. D. 16.10-4. 5 Câu 25: Một bạn học sinh tự thiết kế một thí nghiệm điện phân đơn giản như sau: Cho hai lõi bút chì làm hai điện cực và nối với một nguồn điện một chiều 9V và nhúng với dung dịch muối ăn (nồng độ 20%) đã khuấy đều. Dung dịch thu được cĩ tính tẩy màu. Phương trình hố học điện phân dung dịch muối ăn: điện phân 2NaCl + 2H2O 2NaOH + H2 + Cl2 Dung dịch thu được cĩ tên gọi là A. Xút ăn da.B. Nước chlorine. C. Nước Javel.D. Nước muối sinh lý. Câu 26: Phát biểu nào sau đây khơng đúng? A. Trong tự nhiên khơng tồn tại đơn chất halogen. B. Tính oxi hố của đơn chất halogen giảm dần từ F2 đến I2. C. Khí chlorine ẩm và nước chlorine đều cĩ tính tẩy màu. - D. Fluorine cĩ tính oxi hố mạnh hơn chlorine, oxi hố Cl trong dung dịch NaCl thành Cl2 Câu 27: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí chlorine (đkc) cần dùng là (Cho Fe = 56) A. 8,96 lít.B. 3,36 lít. C. 7,437 lít.D. 2,24 lít. Câu 28: Cho các dung dịch hydrofluoric, potassium iodide, sodium chloride, kí hiệu ngẫu nhiên là X, Y, Z. Khi dùng thuốc thử silicon dioxide và silver nitrate để nhận biết Y, Z thu được kết quả cho trong bảng sau: Chất thử Thuốc thử Hiện tượng Y Silicon dioxide Silicon dioxide bị hồ tan Z Silver nitrate Cĩ kết tủa màu vàng Các dung dịch ban đầu được kí hiệu tương ứng là A. Z, Y, X. B. Y, X, Z. C. Y, Z, X. D. X, Z, Y. PHẦN TỰ LUẬN (3 điểm) to Câu 29 (1,0 điểm): Cho sơ đồ phản ứng sau: Cl2 + KOH KCl + KClO3 + H2O. Cân bằng phản ứng trên theo phương pháp thăng bằng electron, xác định chất oxi hĩa, chất khử. Câu 30 (1,0 điểm): Cho biết năng lượng liên kết trong các phân tử O 2, N2, và NO lần lượt là 498 kJ/mol, 945 kJ/mol và 607 kJ/mol. a) Tính biến thiên enthalpy chuẩn của phản ứng: N2(g) + O2(g) → 2NO(g). b) Giải thích vì sao nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi cĩ tia lửa điện. Câu 31 (0,5 điểm): Khi nhiệt độ tăng thêm 100C, tốc độ một phản ứng tăng lên 3 lần. Để tốc độ phản ứng đĩ (đang tiến hành ở 300C) tăng lên 81 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu? Câu 32 (0,5 điểm): Trong các nhà máy cung cấp nước sinh hoạt thì khâu cuối cùng của việc xử lí nước là khử trùng nước. Một trong những phương pháp khử trùng nước đang được dùng phổ biến ở nước ta là dùng chlorine. Lượng chlorine được bơm vào nước trong bể tiếp xúc theo tỉ lệ 5 gam/m 3. Nếu với dân số của một tỉnh là 3,5 triệu người, mỗi người dùng 200 L nước/ngày, thì các nhà máy cung cấp nước sinh hoạt cần dùng bao nhiêu kg clo mỗi ngày cho việc xử lí nước? 6 ĐỀ MINH HỌA SỐ 3 PHẦN TRẮC NGHIỆM (7 điểm) Câu 1: Iron (Fe) cĩ số oxi hố +2 trong hợp chất nào sau đây? A. Fe3O4.B. FeCl 3. C. FeO.D. Fe 2O3. Câu 2: Phản ứng nào sau đây là phản ứng oxi hĩa – khử? t0 t0 A. 2Ca O2 2CaO .B. CaCO3 CaO CO2 . t0 C. CaO H 2O Ca(OH)2 .D. Ca(OH)2 CO2 CaCO3 H2O. Câu 3: Phản ứng thu nhiệt là phản ứng A. giải phĩng năng lượng dưới dạng nhiệt. B. hấp thụ năng lượng dưới dạng nhiệt. C. tỏa nhiệt ra mơi trường. D. trong đĩ các chất sản phẩm thu nhiệt từ mơi trường. Câu 4: Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành a mol chất đĩ từ những đơn chất bền vững nhất ở điều kiện chuẩn. Giá trị của a là A. 2. B. 1.C. 4.D. 3. o Câu 5: Quy ước về dấu của nhiệt phản ứng ( rH298 ) nào sau đây là đúng? o o A. Phản ứng tỏa nhiệt cĩ rH298 > 0.B. Phản ứng thu nhiệt cĩ rH298 < 0. o o C. Phản ứng tỏa nhiệt cĩ rH298 < 0. D. Phản ứng thu nhiệt cĩ rH298 = 0. Câu 6: Cho phương trình nhiệt hĩa học của phản ứng: o 2H2(g) + O2(g) 2H2O(l) = -571,68kJ. rH298 Phản ứng trên là phản ứng A. thu nhiệt. B. tỏa nhiệt. C. khơng cĩ sự thay đổi năng lượng. D. cĩ sự hấp thụ nhiệt lượng từ mơi trường xung quanh. Thơng tin chung cho câu 7, 8. Xét phản ứng: CaCO3 + 2HCl → CaCl2 + CO2 + H2O. Theo dõi thể tích CO2 thốt ra theo thời gian, thu được đồ thị sau: Câu 7: Đồ thị cho thấy, theo thời gian trong khoảng từ đầu đến 75 giây, thì lượng CO2 sẽ A. tăng dần. B. giảm dần.C. khơng đổi. D. lúc đầu tăng, sau đĩ giảm. Câu 8: Tốc độ trung bình của phản ứng từ thời điểm đầu đến 75 giây là A. 3 mL/s.B. 0,33 mL/s.C. 50 mL/s.D. 25 mL/s. Câu 9: Xét phản ứng: 2CO + O2 → 2CO2. Phát biểu nào sau đây đúng? A. Khi phản ứng hĩa học xảy ra, nồng độ CO tăng dần theo thời gian. B. Khi phản ứng hĩa học xảy ra, nồng độ O2 giảm dần theo thời gian. C. Khi phản ứng hĩa học xảy ra, nồng độ CO2 giảm dần theo thời gian. D. Khi phản ứng hĩa học xảy ra, nồng độ CO2 khơng đổi theo thời gian. Câu 10: Phát biểu nào sau đây đúng? A. Giá trị hệ số nhiệt độ Van’t Hoff (γ) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh. B. Giá trị hệ số nhiệt độ Van’t Hoff (γ) càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng yếu. C. Nhiệt độ khơng ảnh hưởng đến tốc độ phản ứng. D. Tăng nhiệt độ sẽ làm giảm tốc độ phản ứng. 7 Câu 11: Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong A. một đơn vị thời gian.B. một phút.C. một giây.D. một giờ. Câu 12: Vị trí của nhĩm halogen trong bảng tuần hồn các nguyên tố hĩa học là A. Nhĩm VIA.B. Nhĩm IIA.C. Nhĩm VA.D. Nhĩm VIIA. Câu 13: Nhận định nào sau đây đúng khi nĩi về tính chất vật lí của bromine trong điều kiện thường? A. là chất lỏng, màu nâu đỏ.B. là chất lỏng, màu vàng lục. C. là chất rắn, màu tím đen.D. là chất khí, màu tím đen. Câu 14: Trong các halogen: F2, Cl2, Br2, I2. Nhiệt độ nĩng chảy và nhiệt độ sơi cao nhất là A. I2.B. Cl 2. C. Br2.D. F 2. Câu 15: Dung dịch hydrohalic nào sau đây cĩ tính acid yếu? A. HCl.B. HF.C. HBr.D. HI. Câu 16: Thành phần chính của muối ăn là A. NaBr.B. NaClO.C. NaCl.D. NaI. Câu 17: Để phân biệt các ion halide (X-) trong dung dịch muối, cĩ thể dùng dung dịch A. KOH.B. HCl.C. AgNO 3.D. NaCl. Câu 18: Số oxi hĩa của chromium (Cr) trong Na2CrO4 là A. -2 B. +2 C. +6D. 6+ Câu 19: Cho phản ứng: 2SO2 + O2 → 2SO3. Vai trị của các chất trong phản ứng là A. SO2 vừa là chất khử vừa là chất oxi hĩa. B. SO2 là chất khử, O2 là chất oxi hĩa. C. SO2 là chất oxi hĩa. D. SO2 là chất oxi hĩa, O2 là chất khử. Câu 20: Phương trình hĩa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)? A. 2C(graphite) O2(g) 2CO(g) B. C(graphite) + O(g) CO(g) 1 C. C(graphite) O CO D. C(graphite) CO 2CO 2 2(g) (g) 2(g) (g) 3 Câu 21: Biết rằng ở điều kiện chuẩn, 1 mol ethanol (C2H5OH) cháy tỏa ra một nhiệt lượng là 1, 37 x10 kJ. Nếu đốt cháy hồn tồn 15,1 gam ethanol, năng lượng được giải phĩng ra dưới dạng nhiệt bởi phản ứng là (cho nguyên tử khối C=12 H=1 O=16) A. 0,450 kJ.B. 2,25.10 3 kJ. C. 4,5.102 kJ.D. 1,37.10 3 kJ. Câu 22: Cho phản ứng hố học xảy ra ở điều kiện chuẩn sau: 2NO2(g) (đỏ nâu) N2O4(g) (khơng màu) o Biết NO2 và N2O4 cĩ f H 2 9 8 tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Cho các phát biểu sau: (a) Phản ứng trên là phản ứng tỏa nhiệt. (b) Biến thiên enthalpy của phản ứng là -57,2 KJ. (c) N2O4 bền vững hơn NO2. (d) Ở điều kiện chuẩn, cứ 1 mol NO2 thạo thành từ các đơn chất ở dạng bền vững nhất giải phĩng nhiệt lượng là 33,18 kJ. Số phát biểu đúng là A. 1.B. 2.C. 3.D. 4. Câu 23: Tốc độ của phản ứng nào sau đây thay đổi khi áp suất thay đổi? A. CuO(s) + 2HCl(aq) → CuCl2(aq) + H2O(l)B. CaO(s) + SiO 2(s) → CaSiO3(s). C. H2(g) + Cl2(g) → 2HCl(g). D. 2KI(aq) + H2O2(aq) → I2(s) + 2KOH(aq). Câu 24: Cho phản ứng: Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g). Yếu tố nào sau đây khơng ảnh hưởng đến tốc độ phản ứng? A. Diện tích bề mặt zinc.B. Nồng độ dung dịch sulfuric acid. C. Thể tích dung dịch sulfuric acid.D. Nhiệt độ của dung dịch sulfuric acid. Câu 25: Cho phản ứng: Cl2 + 2NaBr → 2NaCl + Br2. Phát biểu nào sau đây đúng? - A. Cl2 cĩ tính oxi hĩa kém Br2. B. Cl2 cĩ tính oxi hĩa mạnh hơn ion Br . C. Cl2 cĩ tính oxi hĩa mạnh hơn Br2. D. Br2 cĩ tính oxi hĩa mạnh hơn Cl2. 8 Câu 26: Để điều chế khí chlorine, người ta cho các chất như MnO2 hoặc KMnO4 tác dụng với hydrochloric acid. Tính thể tích khí chlorine ở đkc tạo ra từ phản ứng dưới đây, biết khối lượng MnO2 đã tham gia phản ứng là 1,74 gam, giả sử hiệu suất phản ứng là 100%. (cho nguyên tử khối Mn=55 O=16) A. 0,124 lít.B. 0,224 lít. C. 0,448 lít.D. 0,4958 lít. Câu 27: Hydrochloric acid lỗng thể hiện tính oxi hĩa khi tác dụng với chất nào sau đây? A. Fe.B. CuO.C. KOH.D. Fe 2O3. Câu 28: Cho một thỏi Aluminium (Al) cĩ khối lượng 5,4 gam vào dung dịch chứa a mol HCl. Sau khi phản ứng kết thúc, thu được 1,335 gam muối chloride. Giá trị của a là A. 0,6.B. 0,01.C. 0,03.D. 0,2. PHẦN TỰ LUẬN (3 điểm) Câu 29 (1,0 điểm): Lập phương trình hĩa học của phản ứng oxi hĩa - khử sau theo phương pháp thăng bằng electron: FeSO4 + KMnO4 + H2SO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O Câu 30 (1,0 điểm): Cho phản ứng đốt cháy bezene (C6H6) và propane (C3H8) như sau: o 15 t C6H6(l) + O2(g) 6CO2(g) + 3H2O(l) (1) 2 o t C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(l) (2) a) Tính biến thiên enthalpy của phản ứng (1) và (2) ở điều kiện chuẩn. b) So sánh lượng nhiệt sinh ra khi đốt cháy hồn tồn 1,0 gam C3H8(g) với đốt cháy hồn tồn 1,0 gam C6H6(l). 0 Cho biết nhiệt tạo thành chuẩn ∆fH298 của C6H6(l), H2O(l) và CO2(g), C3H8(g) lần lượt là 49 kJ/mol, - 285,84 kJ/mol và -393,5 kJ/mol, -105 kJ/mol. Câu 31 (0,5 điểm): Một phản ứng cĩ hệ số nhiệt độ Van’t Hoff bằng 2,5. Ở 15°C, tốc độ của một phản ứng là 0,2 (mol/L.s). Tính tốc độ của phản ứng ở 40°C và 45°C. Câu 32 (0,5 điểm): Cho m gam muối carbonate phản ứng hồn tồn với dung dịch HCl dư thu được 7,437 lít khí CO2 (đkc) và 32,3 gam muối chloride. Tính m. 9
File đính kèm:
 de_cuong_on_tap_cuoi_hoc_ky_ii_hoa_hoc_10_de_minh_hoa_so_1_3.docx
de_cuong_on_tap_cuoi_hoc_ky_ii_hoa_hoc_10_de_minh_hoa_so_1_3.docx

