Đề cương ôn tập học kì II Hóa học 10 - Chủ đề 4-7 - Năm học 2022-2023 - Tài Hoàng Anh
Bạn đang xem tài liệu "Đề cương ôn tập học kì II Hóa học 10 - Chủ đề 4-7 - Năm học 2022-2023 - Tài Hoàng Anh", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập học kì II Hóa học 10 - Chủ đề 4-7 - Năm học 2022-2023 - Tài Hoàng Anh
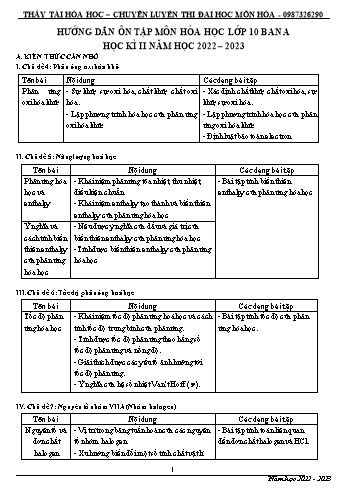
THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 HƯỚNG DẪN ÔN TẬP MÔN HÓA HỌC LỚP 10 BAN A HỌC KÌ II NĂM HỌC 2022 – 2023 A. KIẾN THỨC CẦN NHỚ I. Chủ đề 4: Phản ứng oxi hóa khử Tên bài Nội dung Các dạng bài tập Phản ứng - Sự khử, sự oxi hóa, chất khử, chất oxi - Xác định chất khử, chất oxi hóa, sự oxi hóa khử hóa. khử, sự oxi hóa. - Lập phương trình hóa học của phản ứng - Lập phương trình hóa học của phản oxi hóa khử. ứng oxi hóa khử. - Định luật bảo toàn electron. II. Chủ đề 5: Năng lượng hoá học Tên bài Nội dung Các dạng bài tập Phản ứng hóa - Khái niệm phản ứng tỏa nhiệt, thu nhiệt, - Bài tập tính biến thiên học và điều kiện chuẩn. enthalpy của phản ứng hóa học enthalpy - Khái niệm enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học Ý nghĩa và - Nêu được ý nghĩa của dấu và giá trị của cách tính biến biến thiên enthalpy của phản ứng hóa học thiên enthalpy -Tính được biến thiên enthalpy của phản ứng của phản ứng hóa học hóa học III. Chủ đề 6: Tốc độ phản ứng hoá học Tên bài Nội dung Các dạng bài tập Tốc độ phản - Khái niệm tốc độ phản ứng hoá học và cách - Bài tập tính tốc độ của phản ứng hóa học tính tốc độ trung bình của phản ứng. ứng hóa học. - Tính được tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ. - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng. - Ý nghĩa của hệ số nhiệt Van’t Hoff ( ). IV. Chủ đề 7: Nguyên tố nhóm VIIA (Nhóm halogen) Tên bài Nội dung Các dạng bài tập Nguyên tố và - Vị trí trong bảng tuần hoàn của các nguyên - Bài tập tính toán liên quan đơn chất tố nhóm halogen. đến đơn chất halogen và HCl. halogen - Xu hướng biến đổi một số tính chất vật lí 1 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 của các đơn chất halogen. - Xu hướng thể hiện tính oxi hoá của các đơn chất halogen. B. MỘT SỐ CÂU HỎI THAM KHẢO I. PHẦN TRẮC NGHIỆM Câu 1. Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây? t0 as A. 2Na + Cl2 2NaCl. B. H2 + Cl2 2HCl. t0 C. 2FeCl2 + Cl2 2FeCl3. D. 2NaOH + Cl2 NaCl + NaClO + H2O. Câu 2. Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận A. electron. B. neutron. C. proton. D. cation. Câu 3. Iron (Fe) có số oxi hóa +2 trong hợp chất nào sau đây? A. Fe(OH)3. B. FeCl3. C. FeSO4. D. Fe2O3. Câu 4. Cho nước Cl 2 vào dung dịch NaBr xảy ra phản ứng hóa học: Cl 2 + 2NaBr 2NaCl + Br2. Trong phản ứng hóa học trên, xảy ra quá trình oxi hóa chất A. NaCl. B. Br2. C. Cl2. D. NaBr. Câu 5. Cho phương trình nhiệt hóa học của phản ứng: o N2(g) + O2(g) 2NO(g) rH298 = +179,20 kJ Phản ứng trên là phản ứng A. thu nhiệt. B. tỏa nhiệt. C. không có sự thay đổi năng lượng. D. có sự giải phóng nhiệt lượng ra môi trường. Câu 6. Cho phương trình nhiệt hóa học của phản ứng trung hòa sau: HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l) ∆H = –57,3 kJ Phát biểu nào sau đây không đúng? A. Cho 1 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ. B. Cho HCl dư tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ. C. Cho 1 mol HCl tác dụng với 1 mol NaOH tỏa nhiệt lượng là 57,3 kJ. D. Cho 2 mol HCl tác dụng với NaOH dư tỏa nhiệt lượng là 57,3 kJ. Câu 7. Phản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P): 0 P(s, đỏ) P(s, trắng) rH298 = 17,6 kJ Điều này chứng tỏ phản ứng A. thu nhiệt, P đỏ bền hơn P trắng. B. thu nhiệt, P trắng bền hơn P đỏ. C. tỏa nhiệt, P đỏ bền hơn P trắng.D. tỏa nhiệt, P trắng bền hơn P đỏ. Câu 8: Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại lượng nào dưới đây? A. Nhiệt độ. B. Tốc độ phản ứng. C. Áp suất. D. Thể tích khí. Câu 9: Trong các phản ứng sau, phản ứng nào xảy ra với tốc độ nhanh nhất? 2 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 A. Quá trình quang hợp B. Quá trình gỉ của sắt. C. Quá trình đốt cháy magnesium trong oxygen. D. Quá trình lên men rượu. Câu 10: Thực hiện phản ứng sau trong bình kín: H2 (g) + Br2 (g) → 2HBr (g) thu được số liệu như sau: Thời gian (phút) Nồng độ Br2 (M) t1 = 0 0,072 t2 = 2 0,048 Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là A. 8.10-4 mol/(L.s). B. 2.10-4 mol/(L.s). C. 6.10-4 mol/(L.s).D.4.10 -4 mol/(L.s). Câu 11: Cho đồ thị thể hiện sự thay đổi tốc độ phản ứng của một phản ứng hóa học. Thời điểm nào phản ứng dừng lại? A. Sau 100 giây. B. Sau 50 giây. C. Sau 70 giây. D. Sau 80 giây. Câu 12: Tốc độ phản ứng tại một thời điểm của phản ứng đơn giản 2X + Y → Z được tính bằng biểu thức: 2 v k.CX .CY . Hằng số tốc độ k phụ thuộc vào A. nồng độ của chất. B. nồng độ của chất B. C. nhiệt độ của phản ứng. D. thời gian xảy ra phản ứng. Câu 13: Cho phản ứng thực hiện trong bình khí có piston: X(g) + 2Y(g) → Z(g) + T(g). Khi nén piston làm tăng áp suất chung hỗn hợp đầu lên 2 lần thì tốc độ phản ứng tăng lên A. 9 lần. B. 8 lần. C. 4 lần. D. 6 lần. Câu 14: Cho phản ứng: 2SO2 + O2 2SO3. Tốc độ phản ứng thuận thay đổi bao nhiêu lần nếu thể tích hỗn hợp giảm đi 3 lần? A. 3.B. 6.C. 9.D. 27. 3 Câu 15: Cho phản ứng: N2(g) + 3H2(g) → 2NH3(g) có biểu thức tốc độ tức thời: v = k. CN2. CH2 . Nếu nồng độ của H2 giảm 2 lần, giữ nguyên nồng độ của N2 thì tốc độ phản ứng sẽ: A. tăng 8 lần.B. tăng 2 lần. C. giảm 8 lần.D. tăng 4 lần. 3 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 Câu 16: Biết rằng khi nhiệt độ tăng lên 10℃ thì tốc độ của một phản ứng tăng lên 2 lần. Khi tăng nhiệt độ từ 20℃ đến 100℃ tốc độ phản ứng tăng A. 16 lần.B. 256 lần.C. 64 lần. D. 14 lần. Câu 17: Chất làm tăng tốc độ phản ứng hoá học mà không bị biến đổi chất được gọi là A. chất xúc tác.B. chất trung gian.C. chất sản phẩm.D. chất tham gia. Câu 18: Nhận định nào dưới đây là đúng? A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng. B. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng. C. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm. D. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng tới tốc độ phản ứng. Câu 19: Sự thay đổi nào dưới đây không làm tăng tốc độ phản ứng xảy ra giữa dây magnesium và dung dịch hydrochloric acid? A. Cuộn dải magnesium thành một quả bóng nhỏ.B. Nghiền mảnh magnesium thành bột. C. Tăng nồng độ của hydrochloric acid.D. Tăng nhiệt độ của hydrochloric acid. Câu 20: Yếu tố nào dưới đây đã được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín (cơm, ngô, khoai, sắn) để ủ rượu? A. Nhiệt độ. B. Chất xúc tác. C. Nồng độ. D. Áp suất. Câu 21: Cho phản ứng hoá học: 2KClO3(s) 2KCl(s) + 3O2(g). Yếu tố nào sau đây không ảnh hưởng tới tốc độ của phản ứng trên? A. Nhiệt độ. B. Chất xúc tác. C. Áp suất. D. Kích thước tinh thể KClO 3. Câu 22: Cho 5 gam zinc viên vào cốc đựng 50 mL dung dịch H 2SO4 4 M ở nhiệt độ thường (25 ℃). Trường hợp nào tốc độ phản ứng không đổi? A. Thay 5 gam zinc viên bằng 5 gam zinc bột. B. Thay dung dịch H2SO4 4 M bằng dung dịch H2SO4 2 M. C. Thực hiện phản ứng ở 50 ℃. D. Dùng dung dịch H2SO4 4 M với thể tích gấp đôi. Câu 23: Trường hợp nào sau đây có yếu tố làm giảm tốc độ phản ứng? A. Đưa sulfur đang cháy ngoài không khí vào bình chứa oxygen. B. Quạt bếp than đang cháy. C. Thay hạt aluminum bằng bột aluminum để cho tác dụng với dung dịch HCl. D. Dùng dung dịch loãng các chất tham gia phản ứng. Câu 24. Trong bảng tuần hoàn, nguyên tố halogen là các nguyên tố nhóm nào? A. IA.B. IIA.C. VIA.D. VIIA. Câu 25. Nguyên tố nào sau đây không phải là nguyên tố halogen? A. Fluorine.B. Bromine.C. Oxygen.D. Iodine. Câu 26. Ở điều kiện thường, đơn chất chlorine có màu: A. lục nhạt.B. vàng lục.C. nâu đỏ.D. tím đen. Câu 27. Phản ứng giữa đơn chất halogen nào sau đây với hydrogen diễn ra mãnh liệt, nổ ngay cả trong bóng tối hoặc ở nhiệt độ thấp? A. I2. B. Br2.C. Cl 2.D. F 2. Câu 28. Dung dịch Br2 có thể phản ứng được với dung dịch nào sau đây? A. NaF.B. NaCl.C. NaBr.D. NaI. 4 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 Câu 29: Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là A. ns 2np4.B. ns 2 np5..C. ns 2np3.D. ns 2np6. Câu 30: Liên kết trong các phân tử đơn chất halogen là A. cộng hóa trị không cực.B. cộng hóa trị có cực. C. liên kết ion.D. liên kết cho nhận. Câu 31: Cho 4 đơn chất F2 ; Cl2 ; Br2 ; I2. Chất có nhiệt độ sôi cao nhất là: A. F2. B. Cl 2. C. Br 2. D. I 2. Câu 32: Cấu tạo của nguyên tử fluorine được mô tả như sau: Tổng số hạt mang điện trong nguyên tử fluorine là A. 9. B. 38. C. 19. D. 18. Câu 33: Halogen nào là chất rắn, khi đun nóng chuyển thành khí màu tím, được dùng để sát trùng vết thương? A. Chlorine.B. Bromine. C. Iodine.D. Fluorine. Câu 34: Trong các nguyên tố nhóm VIIA sau đây, nguyên tố nào không có đồng vị bền trong tự nhiên? A. Chlorine.B. Bromine.C. Iodine.D. Astatine. Câu 35: Halogen nào là nguyên tố phi kim mạnh nhất trong bảng tuần hoàn? A. Chlorine.B. Bromine.C. Iodine.D. Fluorine. Câu 36: Khoáng vật sylvinite có công thức . A. KCl.MgCl2.6H2O. B. NaCl.KCl. C. CaF2. D. Na3AlF6. Câu 37: Nguyên tố chlorine không có khả năng thể hiện số oxi hoá nào dưới đây? A. +3. B. 0. C. +1. D. +2. Câu 38: Nhận xét nào sau đây về nhóm halogen là không đúng? A. Tác dụng với kim loại tạo muối halide.B. Tác dụng với hidrogen tạo khí hydrogen halide. C. Có đơn chất ở dạng X2. D. Tồn tại chủ yếu ở dạng đơn chất. Câu 39: Các halogen có tính chất hóa học gần giống nhau vì có cùng: A. cấu hình e lớp ngoài cùng.B. tính oxi hóa mạnh. C. số electron độc thân.D. số lớp electron. Câu 40: Chất nào sau đây chỉ có tính oxi hoá, không có tính khử? A. F2.B. Cl 2. C. Br 2.D. I 2. Câu 41: Trong các phản ứng hoá học, để chuyển thành anion, nguyên tử của các nguyên tố halogen đã nhận hay nhường bao nhiêu electron? A. Nhận thêm 1 electron. B. Nhận thêm 2 electron. C. Nhường đi 1 electron. D. Nhường đi 7 electron. Câu 42: Hình ảnh dưới đây mô tả thí nghiệm đốt cháy iron trong khí chlorine. Khói màu nâu đỏ thu được trong bình eclen là chất gì? A. FeCl2.B. FeCl 3.C. Fe.D. Cl 2. Câu 43: Phản ứng hóa học nào dưới đây viết sai? o a /s t A. H2 + Cl2 2HCl.B. Fe + Cl 2 FeCl2. to C. 2Al + 3Cl2 2AlCl3. D. Cl 2 + H2O HCl + HClO. 5 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 Câu 44: Bromine lỏng rất dễ bay hơi và rất độc. Nếu không may làm đổ bromine lỏng có thể sử dụng hóa chất dễ kiếm nào để loại bỏ hoàn toàn lượng bromine này? A. Nước thường. B. Nước muối. C. Nước vôi. D. Nước xà phòng. Câu 45. Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, vệ sinh gia dụng? A. NaBr. B. NaOH. C. Ca(OH)2. D. MgCl2. Câu 46: Sắp xếp các thứ tự thao tác thí nghiệm điều chế khí chlorine và thử tính tẩy màu của chlorine ẩm. Thí nghiệm được mô tả như hình vẽ sau: (1) Kẹp ống nghiệm lên giá đỡ. (2) Đậy miệng ống nghiệm bằng nút cao su có kèm công tơ hút thuỷ tinh chứa lượng nhỏ HCl đặc. (3) Lấy một lượng nhỏ KMnO 4 cho vào ống nghiệm, thêm mẩu giấy màu ẩm vào ống nghiệm. (4) Bóp nhẹ công tơ hút sao cho 3 – 4 giọt dung dịch HCl đặc nhỏ vào ống nghiệm. Thứ tự thực hiện các thao tác thí nghiệm là A. 1, 3, 2, 4. B. 1, 2, 3, 4. C. 1, 3, 4, 2. D. 1, 4, 2, 3. Câu 47: Muối iodide có tác dụng sản sinh ra hormone tuyến giáp, giúp điều hòa thân nhiệt cơ thể ổn định, điều chỉnh sự phát triển ổn định hệ thần kinh trung ương. Với trẻ nhỏ, đủ iodine sẽ giúp trẻ phát triển trí thông minh, hoạt bát hơn. Muối iodide được nhắc tới ở đây là A. NaI. B. I 2. C. NaCl và I2.D. NaCl và NaI hoặc NaCl và NaIO 3. Câu 48. Cho các phát biểu sau: (a) Nguyên tử halogen chỉ nhận thêm electron khi phản ứng với các chất khác để tạo liên kết hóa học. (b) Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn. (c) Hóa trị phổ biến của các halogen là VII. (d) Khi đơn chất halogen phản ứng với kim loại sẽ tạo hợp chất có liên kết ion. (e) Khi đơn chất halogen phản ứng với một số phi kim sẽ tạo hợp chất có liên kết cộng hóa trị. Trong các phát biểu trên, số phát biểu đúng là A. 1. B. 2. C. 3. D. 4. Câu 49. Chọn phát biểu đúng? A. Từ fluorine đến iodine, tính oxi hóa giảm dần. B. Mức độ phản ứng với hydrogen tăng dần từ fluorine đến iodine. C. Độ bền nhiệt của các phân tử tăng từ HF đến HI. D. Phản ứng hydrogen và iodine là phản ứng một chiều, cần đun nóng. Câu 50. Nguyên nhân dẫn tới nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen tăng từ fluorine đến iodine là do từ fluorine đến iodine A. khối lượng phân tử và tương tác van der Waals đều tăng. B. tính phi kim giảm và tương tác van der Waals tăng. C. khối lượng phân tử tăng và tương tác van der Waals giảm. D. độ âm điện và tương tác van der Waals đều giảm. II. TỰ LUẬN Câu 1. Cân bằng phương trình hoá học của các phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron to a.FeO + HNO3 NO + Fe(NO3)3 + H2O b. H2S + O2(thiếu) S + H2O 6 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 to c. Cl2 + KOH KCl + KClO3 + H2O d.KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O o Câu 2: Xác định rH298 của hai phản ứng sau theo năng lượng liên kết: o a/s t H2(g) + Cl2(g) 2HCl(g) H2(g) + Br2(g) 2HBr(g) Hãy cho biết mức độ thuận lợi của phản ứng theo khía cạnh nhiệt. Điều này có mâu thuẫn với điều kiện thực tế để xảy ra phản ứng không? Tại sao? Cho EH-H = 436 kJ/mol; ECl-Cl = 242 kJ/mol; EH-Cl = 431 kJ/mol; EBr-Br = 192 kJ/mol; EH-Br = 366 kJ/mol. Câu 3: Ở 40℃ dung dịch H 2O2 phân huỷ theo phản ứng: 2H 2O2(aq) 2H2O(l) + O2(g). Nồng độ của H 2O2 tại những thời điểm khác nhau được biểu thị trong bảng sau: Thời điểm (giờ) Nồng độ H2O2 (M) 0 1,000 6 0,0500 12 0,025 Tính tốc độ trung bình của phản ứng phân huỷ H 2O2 (M/ s) trong những khoảng thời gian từ a) 0 đến 6 giờ. b) 6 giờ đến 12 giờ. Câu 4: Cho phản ứng đơn giản: A+ 2B → C. Nồng độ ban đầu các chất: CA = 0,3 M; CB = 0,5 M. Hằng số tốc độ k = 0,4. a) Tính tốc độ phản ứng tại thời điểm ban đầu. b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l. Câu 5: Tốc độ của phản ứng tăng bao nhiêu lần nếu tăng nhiệt độ từ 200℃ đến 240℃, biết khi tăng 10℃ thì tốc độ phản ứng tăng 2 lần. Câu 6: Để hoà tan một mẫu aluminum (Al) trong dung dịch acid hydrochloric acid (HCl) ở 20℃ cần 27 phút. Cũng mẫu aluminum đó tan hết trong dung dịch acid nói trên ở 40℃ trong 3 phút. Tính thời gian (tính theo s) hoà tan mẫu aluminum đó trong dung dịch acid nói trên ở 60℃. Câu 7: Hoàn thành phương trình hoá học của các phản ứng chứng minh tính chất halogen: a) Br2 + K b) F2 + H2O c) Cl2 + Ca(OH)2 d) Cl2 + Nal 70o C e) KOH + Br2 (4) f) H2 + I2 Câu 8: Đốt cháy 11,9 gam hỗn hợp gồm zinc và aluminium trong khí chlorine dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. a. Viết phương trình hoá học xảy ra. b. Tính thể tích khí chlorine (ở đkc) đã phản ứng. Câu 9. Cho 8,4 gam một kim loại R hóa trị II tác dụng vừa đủ với 24,85 gam chlorine. Xác định tên kim loại R và tính khối lượng muối tạo thành. Câu 10. Hòa tan 15 gam muối NaI vào nước được 200 gam dung dịch X. Lấy 100 gam dung dịch X tác dụng vừa đủ với khí Chlorine, thu được m gam muối NaCl. Tính giá trị của m? Câu 11. Hoà tan hoàn toàn 15,4g hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 6,72 lít khí thoát ra (ở đktc) và dung dịch A.Tính khối lượng các kim loại trong hỗn hợp ban đầu. Câu 12: Hỗn hợp 2,2311 L khí A (ở đkc) gồm H 2 và Cl2 có tỉ khối hơi đối với helium là 8,1667. Đun nóng A thu được hỗn hợp khí B. Dẫn khí B qua dung dịch AgNO3 dư, thu được 3,5875 gam kết tủa. a. Tính thành phần phần trăm theo thể tích các khí trong A. b. Tính thành phần phần trăm theo thể tích các khí trong B. 7 Năm học 2022 - 2023 THẦY TÀI HÓA HỌC – CHUYÊN LUYỆN THI ĐẠI HỌC MÔN HÓA - 0987326290 c. Tính hiệu suất của phản ứng giữa H2 và Cl2. Câu 13: Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxygen thu được hỗn hợp Y gồm các oxide có khối lượng 3,33 gam. Tính thể tích (mL) dung dịch hydrochloric acid 2 M vừa đủ để phản ứng hết với hỗn hợp Y. Câu 14: Trong các nhà máy cung cấp nước sinh hoạt thì khâu cuối cùng của việc xử lí nước là khử trùng nước. Một trong các phương pháp khử trùng nước đang được dùng phổ biến ở nước ta là dùng chlorine. Lượng chlorine được bơm vào nước trong bể để tiếp xúc theo tỉ lệ 5g/m 3. Nếu với dân số Hà Nội là 8,5 triệu người (theo thống kê META tổng hợp tính tới tháng 02 năm 2022), mỗi người trung bình dùng 300 L nước/ 1ngày, thì các nhà máy cung cấp nước sinh hoạt cần dùng bao nhiêu kg chlorine mỗi ngày cho việc xử lí nước? Câu 15: Hỗn hợp X gồm K, K2O, K2CO3, Mg, MgO, MgCO3. Hòa tan m gam hỗn hợp X bằngdung dịch HCl vừa đủ thu được 5,6 lít hỗn hợp khí (đktc) có tỉ khối so với hiđro là 16,96 và dung dịch Y chứa 28,31 gam KCl và 0,571m gam MgCl2. Tính giá trị của m? -----------Hết------------ 8 Năm học 2022 - 2023
File đính kèm:
 de_cuong_on_tap_hoc_ki_ii_hoa_hoc_10_chu_de_4_7_nam_hoc_2022.doc
de_cuong_on_tap_hoc_ki_ii_hoa_hoc_10_chu_de_4_7_nam_hoc_2022.doc

