Đề cương ôn tập kiểm tra cuối kì II Hóa học 10 - Bài 13-18 - Năm học 2022-2023 - Quyên Nguyễn (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề cương ôn tập kiểm tra cuối kì II Hóa học 10 - Bài 13-18 - Năm học 2022-2023 - Quyên Nguyễn (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập kiểm tra cuối kì II Hóa học 10 - Bài 13-18 - Năm học 2022-2023 - Quyên Nguyễn (Có đáp án + Ma trận)
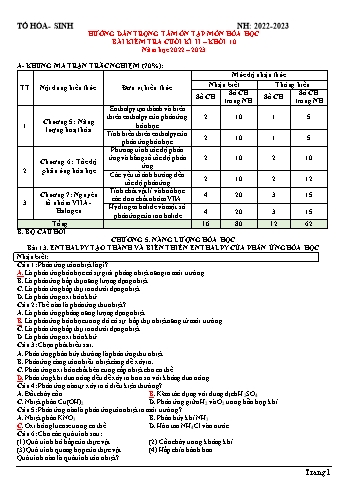
TỔ HÓA- SINH NH: 2022-2023 HƯỚNG DẪN TRỌNG TÂM ÔN TẬP MÔN HÓA HỌC BÀI KIỂM TRA CUỐI KÌ II – KHỐI 10 Năm học 2022 – 2023 A- KHUNG MA TRẬN TRẮC NGHIỆM (70%): Mức độ nhận thức TT Nội dung kiến thức Đơn vị kiến thức Nhận biết Thông hiểu Số CH Số CH Số CH Số CH trong NH trong NH Enthalpy tạo thành và biến thiên enthalpy của phản ứng 2 10 1 5 Chương 5: Năng 1 hóa học lượng hoạt hóa Tính biến thiên enthalpy của 2 10 1 5 phản ứng hóa học Phương trình tốc độ phản ứng và hằng số tốc độ phản 2 10 2 10 Chương 6: Tốc độ ứng 2 phản ứng hóa học Các yếu tố ảnh hưởng đến 2 10 2 12 tốc độ phản ứng Tính chất vật lí và hoá học Chương 7: Nguyên 4 20 3 15 các đơn chất nhóm VIIA 3 tố nhóm VIIA - Hydrogen halide và một số Halogen 4 20 3 15 phản ứng của ion halide Tổng 16 80 12 62 B. BỘ CÂU HỎI CHƯƠNG 5. NĂNG LƯỢNG HÓA HỌC Bài 13. ENTHALPY TẠO THÀNH VÀ BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG HÓA HỌC Nhận biết: Câu 1: Phản ứng tỏa nhiệt là gì? A. Là phản ứng hóa học có sự giải phóng nhiệt năng ra môi trường. B. Là phản ứng hấp thụ năng lượng dạng nhiệt. C. Là phản ứng hấp thụ ion dưới dạng nhiệt. D. Là phản ứng oxi hóa khử. Câu 2: Thế nào là phản ứng thu nhiệt? A. Là phản ứng phóng năng lượng dạng nhiệt. B. Là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ môi trường. C. Là phản ứng hấp thụ ion dưới dạng nhiệt. D. Là phản ứng oxi hóa khử. Câu 3: Chọn phát biểu sai. A. Phản ứng phân hủy thường là phản ứng thu nhiệt. B. Phản ứng càng tỏa nhiều nhiệt càng dễ xảy ra. C. Phản ứng oxi hóa chất béo cung cấp nhiệt cho cơ thể. D. Phản ứng khi đun nóng đều dễ xảy ra hơn so với không đun nóng. Câu 4: Phản ứng nào tự xảy ra ở điều kiện thường? A. Đốt cháy cồn.B. Kẽm tác dụng với dung dịch H 2SO4. C. Nhiệt phân Cu(OH)2.D. Phản ứng giữa H 2 và O2 trong hỗn hợp khí. Câu 5: Phản ứng nào là phản ứng tỏa nhiệt ra môi trường? A. Nhiệt phân KNO3. B. Phân hủy khí NH3. C. Oxi hóa glucose trong cơ thể.D. Hòa tan NH 4Cl vào nước. Câu 6: Cho các quá trình sau: (1) Quá trình hô hấp của thực vật. (2) Cồn cháy trong không khí. (3) Quá trình quang hợp của thực vật. (4) Hấp chín bánh bao. Quá trình nào là quá trình tỏa nhiệt? Trang 1 TỔ HÓA- SINH NH: 2022-2023 A. (1) và (3). B. (2) và (3). C. (1) và (2). D. (3) và (4). Câu 7: Khi đun nóng ống nghiệm đựng KMnO4 (thuốc tím), nhiệt của ngọn lửa làm cho KMnO4 bị nhiệt phân, tạo ra hỗn hợp bột màu đen: 2KMnO4 → K2MnO4 + MnO2 + O2 Phản ứng trên thuộc loại phản ứng nào? A. Phản ứng tỏa nhiệt.B. Phản ứng thu nhiệt. C. Phản ứng không hóa hợp.D. Phản ứng trao đổi. Câu 8: Trong các quá trình sau quá trình nào là quá trình thu nhiệt: 0 0 A. Vôi sống tác dụng với nước. ( ΔrH298 < 0). B. Đốt than đá. ( ΔrH298 < 0). 0 0 C. Đốt cháy cồn. ( ΔrH298 0). Câu 9: Kí hiệu nhiệt tạo thành chuẩn của một chất là 0 0 0 A. ΔrH298 .B. Δf H298 . C. H298..D. Δf H273 . Câu 10: Kí hiệu biến thiên enthalpy chuẩn của phản ứng hóa học là 0 0 A. ΔrH298 .B. H r. C. Δf H298 .D. H 298. Thông hiểu: 0 Câu 1: Cho phản ứng 2H2O(l) 2H2(g) + O2(g) ΔrH298 = + 571,68 kJ. Chọn phát biểu đúng? A. Phản ứng tỏa nhiệt và tự diễn ra ở giai đoạn tiếp diễn. B. Phản ứng thu nhiệt, không tự diễn ra ở điều kiện chuẩn ở giai đoạn tiếp diễn. C. Phản ứng diễn ra ở nhiệt độ thấp. D. Phản ứng tỏa nhiệt, không tự diễn ra ở điều kiện chuẩn ở giai đoạn tiếp diễn. 0 Câu 2: Cho phản ứng: 2H2(g) + O2(g) 2H2O(l) rH298 = -571,68 kJ. Chọn phát biểu đúng? A. Phản ứng tỏa nhiệt và tự diễn ra ở điều kiện chuẩn ở giai đoạn tiếp diễn. B. Phản ứng thu nhiệt, không tự diễn ra ở điều kiện chuẩn ở giai đoạn tiếp diễn. C. Phản ứng diễn ra ở nhiệt độ thấp D. Phản ứng tỏa nhiệt, không tự diễn ra ở giai đoạn tiếp diễn. Câu 3: Biến thiên enthalpy của một phản ứng được ghi ở sơ đồ dưới. Kết luận nào sau đây là đúng? A. Phản ứng tỏa nhiệt. B. Năng lượng chất tham gia phản ứng nhỏ hơn năng lượng sản phẩm. C. Phản ứng thu nhiệt. D. Biến thiên enthalpy của phản ứng là a kJ/mol. Câu 4: Cho biết biến thiên enthalpy chuẩn của 2 phản ứng 1 0 CO(g) + O2(g) CO2(g) (1) ΔrH298 = - 283 kJ 2 H +F 2HF (2) Δ H0 = - 546 kJ 2(g) 2(g) (g) r 298 Chọn phát biểu đúng. A. Cả 2 phản ứng đều làm giảm nhiệt độ môi trường xung quanh. B. Cả hai phản ứng đều là phản ứng thu nhiệt. C. Phản ứng (1) xảy ra thuận lợi hơn (2) ở điều kiện thường. D. Phản ứng (2) xảy ra thuận lợi hơn (1) ở điều kiện thường. Câu 5: Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: 0 N2(g) + O2(g) 2NO(g) ΔrH298 = +180kJ Kết luận nào sau đây đúng? A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp. B. Phản ứng tỏa nhiệt. Trang 2 TỔ HÓA- SINH NH: 2022-2023 C. Phản ứng xảy ra thuận lợi ở điều kiện thường. D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường. Bài 14: TÍNH BIẾN THIỂN ENTHALPY CỦA PHẢN ỨNG HÓA HỌC Nhận biết: Câu 1: Cho phản ứng tổng quát : aA (g) + bB (g) ⟶ mM (g) + nN (g) Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết (Eb) là: 표 A. ∆ H298 = Eb(A)+ Eb(B) - Eb(M) - Eb (N). 표 B. ∆ H298 = a × Eb (A) + b × Eb(B) - m × Eb(M) - n × Eb(N). 표 C. ∆ H298 = Eb(M) + Eb(N) - Eb(A) - Eb(B). 표 D. ∆ H298 = m × Eb(M) + n × Eb(N) + a × Eb(A) – b × Eb(B). o Câu 2: Khi biết các giá trị ∆f H298 của tất cả các chất đầu và sản phẩm thì có thể tính được biến thiên enthalpy o của một phản ứng hóa học ∆r H298 theo công thức tổng quát là: o o o o o o A. ∆r H298 = ∑ ∆f H298(cđ) ― ∑ ∆f H298(sp).B. ∆ r H298 = ∑ ∆f H298(sp) ― ∑ ∆f H298(cđ). o o C. ∆r H298 = ∑ Eb(cđ) ― ∑ Eb(sp). D. ∆r H298 = ∑ Eb(sp) ― ∑ Eb(cđ) 0 Câu 3: Tính ∆r H298 của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức tổng quát: o o o o A. ∆r H298 = ∑ Eb(cđ) ― ∑ Eb(sp).B. ∆ r H298 = ∑ ∆f H298(cđ) ― ∑ ∆f H298(sp) o o o o C. ∆r H298 = ∑ Eb(sp) ― ∑ Eb(cđ) D. ∆r H298 = ∑ ∆f H298(sp) ― ∑ ∆f H298(cđ) 0 Câu 4: Tính ∆r H298 của pứng khi biết các giá trị năng lượng liên kết (Eb) được áp dụng trong điều kiện nào? A. Trong đó các chất đều có liên kết cộng hóa trị ở thể rắn khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng. B. Trong đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng. C. Trong đó các chất đều có liên kết cho nhận ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng. D. Trong đó các chất đều có liên kết cộng hóa trị ở thể lỏng khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng. Câu 5: Dựa vào đâu để kết luận một phản ứng là tỏa nhiệt hay thu nhiệt? 0 0 A. Tỏa nhiệt khi ∆r H298 0. 0 0 B. Tỏa nhiệt khi ∆r H298 > 0 và thu nhiệt khi ∆r H298 < 0. 0 0 C. Tỏa nhiệt khi ∆r H298 > 0 và thu nhiệt khi ∆r H298 > 0. 0 0 D. Tỏa nhiệt khi ∆r H298 < 0 và thu nhiệt khi ∆r H298 < 0. Câu 6: Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được A. công thức phân tử của tất cả các chất trong phản ứng. B. công thức cấu tạo của tất cả các chất trong phản ứng. C. công thức đơn giản nhất của tất cả các chất trong phản ứng. D. Cả A, B và C đều sai. Câu 7: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho các chất đều có A. Liên kết cộng hóa trị ở thể khí B. Liên kết cộng hóa trị ở thể lỏng. C. Liên kết cộng hóa trị ở thể rắn. D. Liên kết cộng hóa trị ở mọi trạng thái. Câu 8: Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết khi các chất ở trạng thái nào? A. Chất lỏng; B. Chất rắn;C. Chất khí; D. Cả 3 trạng thái trên. Câu 9: Số lượng mỗi loại liên kết trong phân tử CH3Cl là A. 1 liên kết C – H, 1 liên kết C – Cl; B. 3 liên kết C – H, 1 liên kết H – Cl; C. 2 liên kết C – H, 1 liên kết C – Cl;D. 3 liên kết C – H, 1 liên kết C – Cl. Câu 10: Các cặp phân tử nào sau đây có 2 loại liên kết trong phân tử? Trang 3 TỔ HÓA- SINH NH: 2022-2023 A. CO2 và NH3 B. CH3Cl và CO2 C. CH3Cl và NH3 D. CH3Cl và NH4Cl Thông hiểu: Câu 1: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 1 0 CO2(g) → CO(g) + O2(g) H = +280 kJ 2 r 298 0 Hãy tính giá trị rH298 của phản ứng 2CO(g) + O2(g) → 2CO2 (g). A. +140 kJB. -1120 kJC. -560 kJD. - 420kJ Câu 2: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 0 3Fe(s) + 4H2O(l) → Fe3O4(s) + 4H2(g) rH298 = +26,32kJ 0 Hãy tính giá trị rH298 của phản ứng Fe3O4(s) + 4H2(g) → 3Fe(s) + 4H2O(l). A. -26,32 kJB. +13,16 kJ C. +19,74 kJ D. -10,28 kJ Câu 3: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 0 CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) rH298 = -890,5kJ 0 1 1 Hãy tính giá trị H của phản ứng CH4(g) + O2(g)→ CO2(g) + H2O(l). r 298 2 2 A.– 890,5kJB. 890,5kJ C. 445,25kJD. - 445,25kJ Câu 4: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 1 1 0 H2(g) + I2 (s) → HI(g) H = 26,5kJ 2 2 r 298 0 Hãy tính giá trị rH298 của phản ứng H2(g) + I2 (s) → 2HI(g). A. 53 kJB. -53 kJ C. 13,25 kJ D. -13,25 kJ Câu 5: Cho biến thiên enthalpy của phản ứng tạo thành 1 mol H2O(l) ở điều kiện chuẩn 1 0 H2(g) + O2 (g) → H2O(l) f H = - 285,83kJ 2 298,H2O l Biến thiên enthlpy của phản ứng khi phân hủy 1 mol H2O(l) thành H2(g) và O2(g) ở điều kiện chuẩn là A.-285,83kJ.B. 285,83kJ. C. 571,7kJ. D. -571,7 kJ. BÀI 15: PHƯƠNG TRÌNH TỐC ĐỘ PHẢN ỨNG VÀ HẰNG SỐ TỐC ĐỘ PHẢN ỨNG Nhận biết: Câu 1: Để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng người ta sử dụng khái niệm ? A. Tốc độ phản ứng. B. Cân bằng hoá học. C. Phản ứng một chiều. D. Phản ứng thuận nghịch. Câu 2: Đại lượng đặc trưng cho độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là A. tốc độ phản ứng. B. cân bằng hóa học. C. tốc độ tức thời. D. quá trình hóa học. Câu 3: Hoàn thành phát biểu về tốc độ phản ứng sau: "Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên..(1).. của..(2).. trong một đơn vị..(3).." A. (1) nồng độ, (2) một trong các chất phản ứng hoặc sản phẩm phản ứng, (3) thể tích. B. (1) nồng độ, (2) một trong các chất phản ứng hoặc sản phẩm phản ứng, (3) thời gian. C. (1) thời gian, (2) một trong các chất sản phẩm, (3) nồng độ. D. (1) thời gian, (2) các chất phản ứng, (3) thể tích. Câu 4: Tốc độ phản ứng của phản ứng hóa học là đại lượng đặc trưng cho : A. sự biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian. B. sự biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian. C. sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian. D. sự biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian. Câu 5: Thực hiện phản ứng sau: CaCO 3 + 2HCl CaCl2 + CO2 + H2O. Theo dõi thể tích CO2 thoát ra theo thời gian, thu đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng): Trang 4 TỔ HÓA- SINH NH: 2022-2023 Trong các phát biểu sau, phát biểu nào không đúng? A. Ở thời điểm 90 giây, tốc độ phản ứng bằng 0. B. Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 033 mL/s. C. Tốc độ phản ứng giảm dần theo thời gian. D. Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau. Câu 6: Cho phương trình hóa học: 2KMnO4(aq)+10FeSO4(aq)+ 8H2SO4(aq 5Fe2(SO4)3 (aq)+K2SO4(aq)+2MnSO4(aq)+8 H2O(l) Với cùng một lượng các chất tham gia phản ứng ( 1 mol chất), chất phản ứng hết nhanh nhất là: A. KMnO4.B. FeSO 4 C. H2SO4 D. Cả 3 chất hết cùng lúc Câu 7: Đối với phản ứng: A + 3B 2C, phát biểu nào sau đây đúng A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C. B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C. C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C. D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C. Câu 8: Có phương trình phản ứng : aA + bB cC + dD. Tốc độ phản ứng tại một thời điểm được tính bằng a b biểu thức: v = k C A.C B. Hằng số k phụ thuộc vào : A. Nồng độ của chất B. bản chất của chất phản ứng và nhiệt độ. C. Nhiệt độ của phản ứng . D. Thời gian xảy ra phản ứng. Câu 9: Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước O2 (g) + 2H2 (g) 2H2O (g). Đường cong nào của hydrogen ? A. Đường cong số (1). B. Đường cong số (2). C. Đường cong số (3). D. Đường cong số (2) hoặc (3) đều đúng. Câu 10: Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 2HCl. Biểu thức tốc độ trung bình của phản ứng là 훥 훥 훥 훥 훥 훥 A. 푣 = 2 = 푙2 = 푙. B. 푣 = 2 = 푙2 = 푙. 훥푡 훥푡 훥푡 훥푡 훥푡 훥푡 훥 훥 훥 훥 훥 훥 C. 푣 = 2 = 푙2 = 푙.D. 푣 = 2 = 푙2 = 푙. 훥푡 훥푡 훥푡 훥푡 훥푡 2훥푡 THÔNG HIỂU Câu 1: Thực nghiệm cho biết tốc độ phản ứng A2 + B2 → 2AB được tính theo biểu thức: v = k × 2 × 2 Trong các điều khẳng định dưới đây, khẳng định nào phù hợp với biểu thức trên ? A. Tốc độ phản ứng hoá học được đo bằng sự biến đổi nồng độ các chất phản ứng trong một đơn vị thời gian. B. Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng. C. Tốc độ phản ứng giảm theo tiến trình phản ứng. D. Tốc độ phản ứng tăng lên khi có mặt chất xúc tác. Câu 2: Khi bắt đầu phản ứng, nồng độ một chất là 0,024 M . Sau 10 giây xảy ra phản ứng , nồng độ của chất đó là 0,022 M. Tốc độ phản ứng trung bình trong trường hợp này là : A. 0,0003 M/s.B. 0,00025 M/s .C. 0,00015 M/s. D. 0,0002 M/s. Câu 3: Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hóa học xảy ra, tốc độ phản ứng sẽ A. không đổi cho đến khi kết thúc. B. tăng dần cho đến khi kết thúc. C. chậm dần cho đến khi kết thúc. D. tuân theo định luật tác dụng khối lượng. Câu 4: Phản ứng 3H2 + N2 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào? Trang 5 TỔ HÓA- SINH NH: 2022-2023 A. Bằng 1/2.B. Bằng 3/2. C. Bằng 2/3. D. Bằng 1/3. Câu 5: Đối với phản ứng: A + 3B 2C, phát biểu nào sau đây đúng? A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C. B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C. C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C. D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C. Câu 6: Phương trình tổng hợp ammonia (NH3): N2(g) + 3H2(g) 2NH3(g). Nếu tốc độ tạo thành NH 3 là 0,345 M/s thì tốc độ của chất phản ứng H2 là A. 0,345 M/s. B. 0,690 M/s. C. 0,173 M/s.D. 0,518 M/s. Câu 7: Phản ứng 2NO(g) + O (g) 2NO (g) có biểu thức tốc độ tức thời: v k.C2 .C . Nếu nồng độ của 2 2 NO O2 NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ A. giảm 2 lần.B. giảm 4 lần. C. giảm 3 lần. D. giữ nguyên. Câu 8: Phương trình hóa học của phản ứng: CHCl 3(g) + Cl2(g) CCl4(g) + HCl(g). Khi nồng độ của CHCl3 giảm 4 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ A. tăng gấp đôi. B. giảm một nửa. C. tăng 4 lần.D. giảm 4 lần. 0 Câu 9: Ở 45 C N2O5 bị phân hủy trong dung môi CCl4 theo phương trình: 2N2O5 2N2O4+ O2. Sự thay đổi nồng độ của N2O5theo thời gian như sau: Thời gian (giây) Nồng độ N2O5 (M) t1 = 0 2,33 t2 = 184 2,08 Tốc độ trung bình của phản ứng tính theo N2O5 là A. 6,80.10-4 mol/(L.s).B. 2,72.10 -3 mol/(L.s). C. 6,80.10-3 mol/(L.s). D. 1,36.10-3 mol/(L.s). Câu 10: Thực hiện phản ứng sau trong bình kín: H2 (g) + Br2 (g) → 2HBr (g) thu được số liệu như sau: Thời gian (phút) Nồng độ Br2 (M) t1 = 0 0,072 t2 = 2 0,048 Tốc độ trung bình của phản ứng tính theo Br2 trong khoảng thời gian trên là A. 8. 10-4 mol/(L.s).B. 2. 10 -4 mol/(L.s). C. 6. 10-4 mol/(L.s). D. 4. 10-4 mol/(L.s). Bài 16: CÁC YẾU TỐ ẢNH HƯỞNG ĐẾN TỐC ĐỘ PHẢN ỨNG Nhận biết: Câu 1: Tốc độ phản ứng phụ thuộc vào các yếu tố sau : A. Nhiệt độ.B. Nồng độ, áp suất. C. chất xúc tác, diện tích bề mặt .D. cả A, B và C. Câu 2: Dùng không khí nén thổi vào lò cao để đốt cháy than cốc ( trong sản xuất gang), yếu tố nào ảnh hưởng đến tốc độ phản ứng ? A. Nhiệt độ, áp suất.B. tăng diện tích.C. Nồng độ. D. xúc tác. Câu 3: Tăng nhiệt độ của một hệ phản ứng sẽ dẩn đến sự va chạm có hiệu quả giữa các phân tử chất phản ứng. Tính chất của sự va chạm đó là A. Thoạt đầu tăng , sau đó giảm dần. B. Chỉ có giảm dần. C. Thoạt đầu giảm , sau đó tăng dần. D. Chỉ có tăng dần. Câu 4: Cho phản ứng : Zn(r) + 2HCl (dd) → ZnCl2(dd) + H2(k). Nếu tăng nồng độ dung dịch HCl thì số lần va chạm giữa các chất phản ứng sẽ: A. Giảm, tốc độ phản ứng tạo ra sản phẩm tăng. B. Giảm, tốc độ phản ứng tạo ra sản phẩm giảm. C. Tăng, tốc độ phản ứng tạo ra sản phẩm tăng. D. Tăng, tốc độ phản ứng tạo ra sản phẩm giảm. Câu 5: Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia ? A. Chất lỏng B. Chất rắn C. Chất khí. D. Cả 3 đều đúng. Câu 6: Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch axit clohydric Trang 6 TỔ HÓA- SINH NH: 2022-2023 + Nhóm thứ nhất : Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch axit HCl 2M. + Nhóm thứ hai : Cân 1g bột kẽm và thả vào cốc đựng 300ml dung dịch axit HCl 2M Kết quả cho thấy bọt khí thóat ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do: A. nhóm thứ hai dùng axit nhiều hơn.B. Diện tích bề mặt bột kẽm lớn hơn. C. Nồng độ kẽm bột lớn hơn. D. Cả ba nguyên nhân đều sai. o Câu 7: Cho 5g kẽm viên vào cốc đựng 50ml dung dịch H2SO4 4M ở nhiệt độ thường (25 ). Trường hợp nào tốc độ phản ứng không đổi ? A. Thay 5g kẽm viên bằng 5g kẽm bột. B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M. o C. Thực hiện phản ứng ở 50 C.D. Dùng dung dịch H 2SO4 gấp đôi ban đầu . Câu 8: Điền và hoàn thiện khái niệm về chất xúc tác sau. "Chất xúc tác làm..(1).. tốc độ của phản ứng hóa học, nhưng vẫn ..(2).. khi kết thúc phản ứng" A. (1) thay đổi, (2) được bảo toàn về chất và lượng B. (1) tăng, (2) được bảo toàn về chất và lượng . C. (1) tăng, (2) không được bảo toàn về chất và lượng. D. (1) thay, (2) bị tiêu hao không nhiều. Câu 9: Chất xúc tác là chất A. làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng. B. làm tăng tốc độ phản ứng và bị mất đi sau phản ứng. C. làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng. D. làm giảm tốc độ phản ứng và bị mất đi sau phản ứng. Câu 10:Tốc độ của một phản ứng hóa học A. chỉ phụ thuộc vào nồng độ các chất tham gia phản ứng. B. tăng khi nhiệt độ phản ứng tăng. C. càng nhanh khi giá trị năng lượng hoạt hóa càng lớn. D. không phụ thuộc vào diện tích bề mặt. Thông hiểu: Câu 1: Một bạn học sinh thực hiện hai thí nghiệm: - Thí nghiệm 1: Cho 100 mL dung dịch acid HCl vào cốc (1), sau đó thêm một mẫu zinc (Zn) và đo tốc độ khí H2 thoát ra theo thời gian. - Thí nghiệm 2 (lặp lại tương tự thí nghiệm 1): 100 mL dung dịch acid HCl khác được cho vào cốc (2) rồi cũng thêm một mẫu zinc vào và lại đo tốc độ khí hydrogen thoát ra theo thời gian. Bạn học sinh đó nhận thấy tốc độ thoát khí hydrogen ở cốc (2) nhanh hơn cốc (1). Yếu tố nào sau đây có thể dùng để giải thích hiện tượng mà bạn đó quan sát được? A. Phản ứng ở cốc (2) nhanh hơn nhờ có chất xúc tác. B. Lượng Zn ở cốc (1) nhiều hơn ở cốc (2). C. Acid HCl ở cốc (1) có nồng độ thấp hơn acid ở cốc (2). D. Zn ở cốc (1) được nghiền nhỏ còn Zn ở cốc (2) ở dạng viên. Câu 2:Từ một miếng đá vôi và một lọ đựng dung dịch acid HCl 1 M, thí nghiệm được tiến hành trong điều kiện nào sau đây sẽ thu được một lượng CO2 lớn nhất trong một khoảng thời gian xác định? A. Tán nhỏ miếng đá vôi, cho vào dung dịch HC 1 M, không đun nóng. B. Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1 M, đun nóng. C. Cho miếng đá vôi vào dung dịch HCl 1 M, không đun nóng. D. Cho miếng đá vôi vào dung dịch HCl 1 M, đun nóng. Câu 3: So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như nhau). Zn (bột) + dung dịch CuSO4 1M (1) Zn (hạt) + dung dịch CuSO4 1M (2) Kết quả thu được là. A. (1) nhanh hơn (2). B. (2) nhanh hơn (1). C. như nhau. D. ban đầu như nhau, sau đó (2) nhanh hơn(1). Câu 4: Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ ancol (rượu) ? A. Chất xúc tác. B. áp suất. C. Nồng độ. D. Nhiệt độ. Trang 7 TỔ HÓA- SINH NH: 2022-2023 Câu 5: Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây không đúng khi giải thích cho việc sử dụng nồi áp suất ? A. Tăng áp suất và nhiệt độ lên thức ăn. B. Giảm hao phí năng lượng. C. Giảm thời gian nấu ăn.D. Tăng diện tích tiếp xúc thức ăn và gia vị. 0 푛 2, 푡 Câu 6: Cho phản ứng phân huỷ hydrogen peoxit trong dung dịch. 2H2O2 2H2O + O2 Yếu tố ảnh không hưởng đến tốc độ phản ứng là. A. Nồng độ H2O2.B. Thời gian C. Nhiệt độ. D. Chất xúc tác MnO2. Câu 7: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối potassium chlorate. Người ta sử dụng cách nào sau đây nhằm mục đích tăng tốc độ phản ứng ? A. Nung kaliclorat ở nhiệt độ cao. B. Nung hỗn hợp potassium chlorate và manganese đioxide ở nhiệt độ cao. C. Dùng phương pháp dời nước để thu khí oxi. D. Dùng phương pháp dời không khí để thu khí oxi. Câu 8: Khi cho axit clohiđric tác dụng với postaium pemanganate (rắn) để điều chế chlorine, khí clo sẽ thoát ra nhanh hơn khi dùng A. acid clohiđric đặc và đun nhẹ hỗn hợp. B. axit clohiđric đặc và làm lạnh hỗn hợp. C. acid clohiđric loãng và đun nhẹ hỗn hợp. D. axit clohiđric loãng và làm lạnh hỗn hợp. Câu 9: Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn? A. Cốc 1 tan nhanh hơn.B. Cốc 2 tan nhanh hơn. C. Tốc độ tan ở 2 cốc như nhau. D. BaSO3 tan nhanh nên không quan sát được. Câu 10: Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau. Ở thí nghiệm nào có bọt khí thoát ra chậm nhất? A. Thí nghiệm1 B. Thí nghiệm 2 C. Thí nghiệm 3 D. 3 thí nghiệm như nhau Câu 11: Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau. (1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4. (2) Thêm dung dịch HCl 1M lên thể tích gấp đôi. (3) Nghiền nhỏ hạt sắt thành bột sắt. (4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi. Có bao nhiêu cách thay đổi tốc độ phản ứng? A. 1 B. 2C. 3 D. 4 Câu 12: Cho các phản ứng sau: (a) 2Al(s) + Fe2O3(s) Al2O3(s) + 2Fe(s). (b) 2H2(g) + O2(g) 2H2O(l). (c) C(s) + O2(g) CO2(g). (d) CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g). Số phản ứng khi tăng áp suất của chất phản ứng, tốc độ bị thay đổi là Trang 8 TỔ HÓA- SINH NH: 2022-2023 A. 1.B. 2. C. 3. D. 4. BÀI 17: TÍNH CHẤT VẬT LÍ VÀ HOÁ HỌC CÁC ĐƠN CHẤT NHÓM VIIA Nhận biết: Câu 1: Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là A. 5.B. 7. C. 2. D. 8. Câu 2: Tính chất hoá học đặc trưng của các đơn chất halogen là A. tính khử. B. tính base. C. tính acid.D. tính Oxi hoá. Câu 3: Trong tự nhiên, nguyên tố fluorine tồn tại phổ biến nhất ở dạng hợp chất là A. Na3AlF6. B. NaF. C. HF.D. CaF 2. Câu 4: Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là A. F2. B. Br2.C. I 2. D. Cl2. Câu 5: Muối nào có nhiều nhất trong nước biển với nồng độ khoảng 3%? A. NaCl. B. K. C. MgCl2. D. NaF. Câu 6: Số Oxi hoá cao nhất mà nguyên tử chlorine thể hiện được trong các hợp chất là A. -1.B. +7. C. +5. D. +1. Câu 7: Các nguyên tố halogen thuộc nhóm nào trong bảng tuần hoàn? A. VIIIA. B. VIA.C. VIIA. D. IIA. Câu 8:Trong nhóm halogen, đơn chất có tính Oxi hoá mạnh nhất là A. F2. B. Cl2. C. Br2. D. I2. Câu 9: Khi đun nóng, chất thăng hoa chuyển từ thể rắn sang thể hơi màu tím là A. F2. B. Cl2. C. Br2.D. I 2. Câu 10: Halogen nào sau đây được dùng để khử trùng nước sinh hoạt? A F2.B. Cl 2. C. Br2. D. I2 Câu 11: Trong cơ thể người, nguyên tố iodine tập trung ở tuyến nào sau đây? A. Tuyển thượng thận. B. Tuyển tuy. C. Tuyến yên.D. Tuyến giáp trạng. Câu 12: Trong dãy halogen, nguyên tử có độ âm điện nhỏ nhất là A. fluorine. B. chlorine. C. bromine.D. iodine. Câu 13: Halogen tồn tại thể lỏng ở điều kiện thường là A. fluorine. B. bromine. C. lodine. D. chlorine. Câu 14: Đơn chất halogen ở thể khí, màu vàng lục là A. chlorine. B. lodine. C. bromine. D. fluorine. Câu 15: Halogen nào được dùng trong sản xuất nhựa Teflon? A. Chlorine. B. lodine. C. Fluorine. D. Bromine. Câu 16: Nguyên tố halogen được dùng trong sản xuất nhựa PVC là A. chlorine. B. bromine.C. phosphorus. D. carbon. Câu 17: Halogen được điều chế bằng cách điện phân có màn ngăn dung dịch muối ăn là A. fluorine. B. chlorine. C. bromine. D. iodine. Câu 18: Ở điều kiện thường, chlorine là chất khí, màu vàng lục, có mùi xốc và nặng hơn không khí bao nhiêu lần? A. 1,25 lần.B. 2,45 lần. C. 1,26 lần. D. 2,25 lần. Câu 19: Cho khí chlorine tác dụng với Iron (Fe), sản phẩm sinh ra là A. FeCl2. B. FeCl.C. FeCl 3 D. Fe2Cl3 Câu 20: Kết luận sai là A. Màu sắc của các đơn chất halogen đậm dần từ fluorine đến iodine; B. Trạng thái tập hợp của đơn chất ở 20°C thay đổi: fluorine và chlorine ở thể khí, bromine ở thể lỏng, iodine ở thể rắn; C. Nhiệt độ nóng chảy, nhiệt độ sôi giảm dần fluorine đến iodine; D. Các đơn chất halogen tan ít trong nước, tan nhiều trong các dung môi hữu cơ (riêng fluorine phản ứng mãnh liệt với nước). Thông hiểu: Câu 1: Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây? Trang 9 TỔ HÓA- SINH NH: 2022-2023 A. Nhường 1 electron.B. Nhận 1 electron. C. Nhường 7 electron. D. Góp chung 1 electron. Câu 2: Hít thở không khí có chứa khí nào sau đây vượt ngưỡng 30 μg/m3 không khí (QCVN 06:2009/BTNMT) sẽ tiềm ẩn nguy cơ gây viêm đường hô hấp, co thắt phế quản, khó thở? A. O2 B. Cl 2. C. N2. D. O3. Câu 3: Halogen nào tạo liên kết ion bền nhất với sodium? A. Chlorine. B. Bromine. C. lodine. D. Flourine. Câu 4: Liên kết trong phân tử đơn chất halogen là A. liên kết van der Waals. C. liên kết ion. B. liên kết cộng hoá trị. D. liên kết cho nhận. Câu 5: Đặc điểm của halogen là A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hoá học. B. tạo liên kết cộng hoá trị với nguyên tử hydrogen. C. nguyên tử có số oxi hoá –1 trong tất cả hợp chất. D. nguyên tử có 5 electron hoá trị. Câu 6: Phát biểu nào sau đây là không đúng? A. Trong tự nhiên, không tồn tại đơn chất halogen. B. Tính oxi hoá của đơn chất halogen giảm dần từ F, đến I C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu. D. Fluorine có tính oxi hoá mạnh hơn chlorine, oxi hoá Cl− trong dung dịch NaCl thành Cl2. Câu 7: Cho các phản ứng hóa học sau đây, phản ứng hóa học nào sau đây không đúng A. Cl2 + 2KOH loãng KCl + KClO + H2O. B. Br2 + Fe FeBr2. C. 4F2 + 2H2O 4HF + O2. D. Cl2 + 2NaBr 2NaCl + Br2. Câu 8: Cho phản ứng Cl2 + 2NaBr 2NaCl + Br2. Nhận xét đúng là - - A. tính oxi hóa Br2 > Cl2.B. tính khử Br < Cl . C. tính oxi hóa Cl2 > Br2.D. tính khử Cl 2 > Br2. Câu 9: Số oxi hoá của chlorine trong các chất: NaCl, NaClO, KClO3, Cl2, KClO4 lần lượt là A. –1, +1, +3, 0, +7.B. –1, +1, +5, 0, +7. C. –1, +3, +5, 0, +7. D. +1, –1, +5, 0, +3. Câu 10: Số oxi hóa của bromine trong các hợp chất HBr, HBrO, KBrO3, BrF3 lần lượt là A. -1, +1, +5, +3.B. +1, +1, +5, +3.C. -1, +1, +1, +3.D. -1, +1, +2, +3. Câu 11: Phát biểu nào sau đây là sai? A. Chlorine là chất khí tan vừa phải trong nước. B. Chlorine có số oxi hoá - 1 trong mọi hợp chất. C. Chlorine có tính oxi hoá mạnh hơn bromine và iodine. D. Chlorine chỉ tồn tại trong tự nhiên dưới dạng hợp chất. Câu 12: Chlorine không phản ứng với chất nào sau đây ? A. NaOH.B. NaCl. C. Ca(OH) 2. D. NaBr. Câu 13: Hỗn hợp khí không tồn tại là A. Cl2 + O2 B. Cl2 + N2 C. Cl2 + H2S D. Cl2 + HF. Câu 14: Kim loại nào sau đây tác dụng với dung dịch HCl loãng và tác dụng với khí Cl2 cho cùng loại muối chlorite kim loại? A. FeB. Zn C. Cu D. Ag Câu 15: Khi cho các halogen tác dụng với nước, chỉ có một chất giải phóng khí O2. Chất đó là A. Br2. B. Cl2. C. I2. D. F2. BÀI 18: HYDROGEN HALIDE VÀ MỘT SỐ PHẢN ỨNG CỦA ION HALIDE Nhận biết: Câu 1: Ở trạng thái lỏng, giữa các phân tử hydrogen halide nào sau đây tạo được liên kết hydrogen mạnh? A. HCI. B. HI.C. HF. D. HBr. Câu 2: Hydrogen halide nào sau đây có nhiệt độ sôi cao nhất ở áp suất thường? A. HCI. B. HBr. C. HF.D. HI. Trang 10 TỔ HÓA- SINH NH: 2022-2023 Câu 3: Trong dãy hydrogen halide, từ HF đến HI, độ bền liên kết biến đổi như thế nào? A. Tăng dần.B. Giảm dần. C. Không đổi. D. Tuần hoàn. Câu 4: Dung dịch hydroxalic acid nào sau đây có tính acid yếu? A. HF. B. HBr. C. HCI. D. HI. Câu 5: Nhỏ vài giọt dung dịch nào sau đây vào dung dịch AgNO3 thu được kết tủa màu vàng nhạt? A. HCI.B. NaBr. C. NaCl. D. HF Câu 6: Trong điều kiện không có không khí, đinh sắt (Iron) tác dụng với dung dịch HCl thu được các sản phẩm là A. FeCl3 và H2. B. FeCl2 và Cl2. C. FeCl3 và Cl2.D. FeCl 2 và H2. Câu 7: Hydrohalic acid thường được dùng để đánh sạch bề mặt kim loại trước khi sơn, hàn, mạ điện là. A. HBr. B. HF. C. HI.D. HCI. Câu 8: Hydrohalic acid được dùng làm nguyên liệu để sản xuất hợp chất chống dính teflon là A. HF. B. HCI. C. HBr. D. HI. Câu 9: Dung dịch nào sau đây có thể phân biệt được các ion F-, Cl-, Br-, I- trong dung dịch muối? A. NaOH. B. HCl.C. AgNO 3. D. KNO3. Câu 10: KBr thể hiện tính khử khi đun nóng với dung dịch nào sau đây? A. AgNO3.B. H 2SO4 đặc. C. HCl. D. H2SO4 loãng. Câu 11: Phân tử có tương tác van der Waals lớn nhất là A. HCI. B. HI. C. HBr. D. HF Câu 12: Hydrohalic acid có tính acid mạnh nhất là A. HF. B. HBr. C. HI. D. HCl Câu 13: Hydrohalic acid có tính ăn mòn thuỷ tinh là A. HBr. B. HI. C. HCI. D. HF Câu 14: Liên kết hydrogen của phân tử nào được biểu diễn đúng? A. ...H - I...H - I...H - I... B. ...H - CI...H - CI...H - CI... C. ...H- Br...H- Br...H- Br... D. ...H - F... H - F... H - F... Câu 15: Ion halide được sắp xếp theo chiều giảm dần tính khử: A. F-, Cl-, Br-, I-. B. I -, Br-, Cl-, F-. C. F -, Br-, Cl-, I-. D. I -, Br-, F-, Cl-. Câu 16: Hydrogen halide có nhiều liên kết hydrogen nhất với nước là A. HF. B. HCI. C. HBr. D. HI Câu 17: Chất hay ion nào có tính khử mạnh nhất? - - A. CI2. B. Cl . C. I 2. D. I . Câu 18: Dung dịch dùng để nhận biết các ion halide là A. Quỳ tím. B. AgNO 3. C. NaOH. D. HCl Câu 19: Dùng loại bình nào sau đây để đựng dung dịch HF ? A. Bình thuỷ tinh màu xanh. B. Bình thuỷ tinh mầu nâu. C. Bình thuỷ tinh không màu.D. Bình nhựa teflon (chất dẻo). Câu 20: Thuốc thử để nhận biết ion Cl- có trong dung dịch muối chloride hoặc dung dịch acid HCl là A. AgBr B. Ca(NO3)2 C. AgNO3 D. Ag2SO4. Thông hiểu: Câu 1: Nhận xét nào sau đây về hiđro clorua là không đúng? A. Hiđro clorua có tính axit. B. Hiđro clorua là chất khí ở điều kiện thường. C. Hiđro clorua có mùi xốc. D. Hiđro clorua tan tốt trong nước. Câu 2: Kim loại không phản ứng với dung dịch HCl là A. Fe. B. Zn. C. Cu. D. Al. Câu 3: Kim loại nào sau đây tác dụng với dung dịch HCl loãng và tác dụng với khí clo dư cho cùng loại muối clorua? A. Fe. B. Zn. C. Cu. D. Ag. Câu 4: Kim loại nào sau đây, khi tác dụng với khí Cl2 dư và dung dịch HCl không cho cùng một muối ? A. Zn. B. Mg. C. Al. D. Fe. Câu 5: Trong các phản ứng sau, phản ứng nào không xảy ra? A. Zn + 2HCl ZnCl2 + H2. B. Cu + 2HCl CuCl 2 + H2. C. CuO+2HCl CuCl2 +H2O. D. AgNO3 + HCl AgCl+HNO3. Trang 11 TỔ HÓA- SINH NH: 2022-2023 Câu 6: Dãy gồm các kim loại đều tác dụng được với dung dịch HCl là A. Cu, Fe, Al. B. Fe, Mg, Al. C. Cu, Pb, Ag. D. Fe, Au, Cr. Câu 7: Cho Fe3O4 tác dụng với dung dịch HCl sản phẩm thu được là A. FeCl2 , FeCl3 , H2O.B. FeCl 2 , H2O. C. FeCl3 , H2O.D. FeO, H 2O. Câu 8: Trong dãy hydrogen halide, từ HCl đến HI, nhiệt độ sôi tăng dần chủ yếu do nguyên nhân nào sau đây? A. Tương tác van der Waals tăng dần. B. Phân tử khối tăng dần. C. Độ bền liên kết giảm dần. D. Độ phân cực liên kết giảm dần. Câu 9: Trong dãy hydrogen halide, từ HF đến HI, độ phân cực của liên kết biến đổi như thế nào? A. Tuần hoàn. B. Tăng dần.C. Giảm dần. D. Không đổi. Câu 10: Hydrochloric acid đặc thể hiện tính khử khi tác dụng với chất nào sau đây? A. NaHCO3. B. CaCO3. C. NaOH.D. MnO 2. Câu 11: Hydrochloric acid loãng thể hiện tính Oxi hoá khi tác dụng với chất nào sau đây? A. FeCO3.B. Fe. C. Fe(OH) 2. D. Fe2O3. Câu 12: Thuốc thử nào sau đây phân biệt được hai dung dịch HCl và NaCl? A. Phenolphthalein. B. Hồ tinh bột.C. Quỳ tím. D. Nước brom. Câu 13: Dung dịch HF có khả năng ăn mòn thuỷ tinh là do xảy ra phản ứng hoá học nào sau đây? A. SiO2 + 4HF → SiF4 + 2H2O. B. NaOH + HF → NaF + H2O. C. H2 + F2 → 2HF. D. 2F2 +2H2O → 4HF + O2. Câu 14: Trong dãy hydohalic acid, từ HF đến HI, tính acid tăng dần do nguyên nhân chính là A. tương tác van der Waals tăng dần. B. độ phân cực liên kết giảm dần. C. phân tử khối tăng dần.D. độ bền liên kết giảm dần. Câu 15: Chọn phát biểu không đúng? A. Các hydrogen halide tan tốt trong nước tạo dung dịch acid. B. Ion F- và Cl- không bị oxi hoá bởi dung dịch H2SO4 đặc. C. Các hydrogen halide làm quỳ tím hóa đỏ. D. Tính acid của các hydrohalic acid tăng dần từ HF đến HI. II. TỰ LUẬN Bài 14: TÍNH BIẾN THIỂN ENTHALPY CỦA PHẢN ỨNG HÓA HỌC Vận dụng cao: Câu 1: Cho phương trình hóa học của phản ứng :C2H4 (g) + H2O (l) C2H5OH (l) Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK). Câu 2: Quá trình hòa tan calcium chloride trong nước: 2+ – o CaCl2 (s) Ca (aq) + 2Cl (aq) ΔrH298 = ? 2+ Chất CaCl2 Ca Cl– o ΔfH298 (kJ/mol) –795,0 –542,83 –167,16 Tính biến thiên enthalpy của quá trình. o Câu 3: Cho phương trình nhiệt hóa học của phản ứng sau: C (kim cương) C (graphite) ΔrH298= – 1,9 kJ Kim cương hay graphite là dạng bền hơn của carbon ? Câu 4: Cho hai phương trình nhiệt hóa học sau: 1 o CO (g) + 2 O2 (g) CO2 (g) ΔrH298= – 283,00 kJ (1) o H2 (g) + F2 (g) 2HF (g) ΔrH298= – 546,00 kJ (2) So sánh nhiệt giữa hai phản ứng (1) và (2). Phản ứng nào xảy ra thuận lợi hơn ? Câu 5: Cho hai phương trình nhiệt hóa học sau: o 1 t o CO (g) + 2 O2 (g) CO2 (g) ΔrH298= – 283,00 kJ o 7 t o C2H5OH (l) + 2 O2(g) 2CO2(g) + 3H2O (l) ΔrH298= – 1366,89 kJ Khi đốt cháy cùng 1 mol CO và C2H5OH thì phản ứng nào tỏa ra lượng nhiệt lớn hơn ? Câu 6; Cho các phương trình nhiệt hóa học sau: o 2H2 (g) + O2 (g) 2H2O (l) ΔrH298= – 571,68 kJ Trang 12 TỔ HÓA- SINH NH: 2022-2023 1 1 o 2 H2 (g) + 2 I2 (g) HI (g) ΔrH298= + 25,9 kJ Xác định biến thiên enthalpy của 2 phản ứng sau: 1 o H2 (g) + 2O2 (g) H2O (l) ΔrH298= ? 1 1 o HI (g) 2 H2 (g) + 2 I2 (g) ΔrH298= ? Câu 7: Cho các phương trình nhiệt hóa học của phản ứng: 3 o a) 3H2 (g) + 2 O2 (g) 3H2O (l) ΔrH298= – 857,52 kJ o t o b) 2S(s) + 3O2 (g) 2SO3 (g) ΔrH298= + 792,2 kJ Ở điều kiện chuẩn nếu đốt cháy hoàn toàn 1,2g H2 (a) và 3,2g S (b) thì lượng nhiệt tỏa ra hay cần cung cấp là bao nhiêu ? Câu 8: Dựa vào số liệu về năng lượng liên kết ở Bảng 14.1, hãy tính biến thiên enthalpy của 2 phản ứng sau: 푡0 2H2(G) + O2(G) 2H2O(G) (1) 푡0 C7H16(G) + 11O2(G) 7CO2(G) + 8H2O(G) (2) So sánh kết quả thu được, từ đó cho biết H2 hay C7H16 là nhiên liệu hiệu quả hơn cho tên lửa (biết trong C7H16 có 6 liên kết C-C và 16 liên kết C-H) Câu 9: Cho phương trình nhiệt hóa học sau: o NaOH (aq) + HCl (aq) NaCl (aq) + H2O (l) ΔrH298= – 57,3 kJ a) Vẽ sơ đồ biểu diễn biến thiên enthalpy của phản ứng. b) Tính lượng nhiệt tỏa ra khi dùng dung dịch có chứa 8g NaOH trung hòa với lượng vừa đủ dung dịch HCl. 3 o Câu 10: Phosgene là chất khí không màu, mùi cỏ mục, dễ hóa lỏng; khối lượng riêng 1,420 g/cm (ở 0 C); ts = 8,2 oC. Phosgene ít tan trong nước; dễ tan trong các dung môi hữu cơ, bị thủy phân chậm bằng hơi nước; không cháy; là sản phẩm công nghiệp quan trọng; dùng trong tổng hợp hữu cơ để sản xuất sản phẩm nhuộm, chất diệt cỏ, polyurethane, Phosgene là một chất độc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 – 0,3 mg/L, gây tử vong sau khoảng 15 phút. Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Biết: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol; Eb(C ≡ O) = 1075 kJ/mol. Hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene từ CO và Cl2. BÀI 17: TÍNH CHẤT VẬT LÍ VÀ HOÁ HỌC CÁC ĐƠN CHẤT NHÓM VIIA Vận dụng: Câu 1: Đốt cháy hoàn toàn 0,48 g kim loại M (hoá trị II) bằng khí chlorine, thu được 1,332 g muối chloride. Xác định kim loại M. Câu 2: Cho 1,26 gam bột Al và Mg tác dụng với lượng dư Bromine thì thu dược 10,86 gam hỗn hợp muối. Tính thành phần % theo khối lượng Al trong hỗn hợp đầu? Câu 3: Để oxi hóa hoàn toàn 0,92 gam hỗn hợp gồm Al và Zn ( tỉ lệ 1 : 1 về số mol) thì cần vừa đủ dung dịch chứa m gam Bromine. Tìm giá trị m? Câu 4: Cho khí chlorine dư tác dụng hết với NaI. Sau phản ứng làm bay hơi dung dịch thì thấy khối lượng muối thu đựơc nhỏ hơn khối lượng muối NaI ban đầu là 4,575 gam. Tính khối lượng NaI ban đầu? Câu 5: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Tìm phần trăm khối lượng của Al trong Y? Câu 6: Việt Nam là nước xuất khẩu thuỷ sản thứ 3 trên thế giới, sau Na Uy và Trung Quốc (Theo Bộ Nông nghiệp và Phát triển nông thôn Việt Nam, tháng 12/2021), xuất khẩu tới hơn 170 nước trên thế giới, trong đó có thị trường lớn như Mỹ và Châu Âu, được xem là thị trường khó tính, nên tiêu chuẩn chất lượng được kiểm soát chặt chẽ trước khi nhập nguyên liệu và sau khi thành phẩm, đóng gói. Trong danh mục tiêu chuẩn chất lượng sản phẩm có chỉ tiêu về dư lượng chlorine không vượt quá 1 mg/L (chlorine sử dụng trong quá trình sơ chế nguyên liệu để diệt vi sinh vật). Phương pháp chuẩn độ iodine — thiosulfate được dùng để xác định dư lượng chlorine trong thực phẩm theo phương trình: Trang 13 TỔ HÓA- SINH NH: 2022-2023 Cl2 + 2KI → 2KCI + I2, I2 được nhận biết bằng hồ tinh bột, I2 bị khử bởi dung dịch chuẩn sodium thiosulfate theo phương trình: I2 + 2Na2S2O3 → 2Nal + Na2S4O6 Dựa vào thể tích dung dịch Na2S2O3 phản ứng, tính được dư lượng chlorine trong dung dịch mẫu. Tiến hành chuẩn độ 100 mL dung dịch mẫu bằng dung dịch Na 2S2O3 0,01 M, thể tích Na2S2O3 dùng hết 0,28 mL (dụng cụ chứa dung dịch chuẩn Na 2S2O3 là loại microburet 1 mL, vạch chia 0,01 mL). Mẫu sản phẩm trên đủ tiêu chuẩn về dư lượng chlorine cho phép để xuất khẩu không? Giải thích. Câu 7: Tại sao trong hợp chất của halogen, nguyên tố fluorine chỉ thể hiện số oxi hoá-1và chỉ có tính oxy hóa khi tham gia phản ứng hóa học, còn các nguyên tố chlorine, bromine, iodine ngoài số ôxi hóa -1 còn có +1, +3, +5, +7 và bên cạnh tính oxi hóa còn có thêm tính khử? Viết phương trình minh họa? Câu 8: Dung dịch HBrvà HI đậm đặc không màu, thường được đựng trong lọ thuỷ tinh sầm màu, sau một thời gian sử dụng, dưới ảnh hường của không khí, dung dịch HBr có màu vàng cam, dung dịch HI có màu vàng đậm. Giải thích sự thay đồi màu sắc cùa 2 dung dịch acid trên. Câu 9: Hydrogen chloride được điều chế bằng cách cho tinh thề sodium chloride tác dụng với sulfuric acid đặc. Tuy nhiên, không thề dùng phương pháp này đề điều chế hydrogen bromide. Nêu nguyên nhân và đề nghị phương pháp hoá học điều chế hydrogen bromide. Câu 10: Một học sinh thực hiện thí nghiệm và cho kết quả như sau: Bước 1: Lấy 2 mL dung dịch NaBr vào ống nghiệm, dung dịch không màu. Bước 2: Lấy tiếp 1 mL hexane vào ống nghiệm, lắc mạnh đề quan sát khả năng hoà tan của 2 chất lỏng. Nhận thấy 2 chất lỏng không tan vào nhau và phân tách lớp. Bước 3: Thêm 1 mL nước Cl2 vào ống nghiệm, lắc đều rồi để yên. Quan sát thấy lớp chất lỏng phía trên cỏ màu da cam. Viết phương trình hoá học của phản ứng. Thí nghiệm trên chứng minh tính chất vật lí và hoá học nào của halogen tương ứng? Câu 11: Các hợp chất hypochlorite hay Chlorine (NaClO, Ca(ClO)2) là cáchoá chất có tính oxi hoá rất mạnh, có khả năng sát trùng, sát khuẩn, làm sạch nguồn nước (Chlorine được nhắc đến là tên thương mại, không phải đơn chất Cl2). Chlorine ở nồng độ xác định có khả năng tiêu diệt một số mầm bệnh như: Mầm bệnh Thời gian tiêu diệt E. coli 0157: H7 (gây tiêu chày ra máu, suy thận) < 1 phút HepatilisA virus (gây bệnh viêm gan siêu vi A) 16 phút Kí sinh trùng Giardia (gây tiêu chảy, đau bụng và sụt 45 phút cân) Chlorine cần dùng là tồng lượng chlorine cần thiết để tiêu diệt mầm bệnh và oxi hoá các chất khử trong nước như iron, manganese, hydrogen sulfide và lượng chlorine tự do còn lại sau khoảng thời gian nhất định. Một nhà máy xử lí nước muốn làm sạch 1 lít nước thì lượng chlorine cần dùng trong 1 ngày là 11 mg đề duy trì lượng chlorine tự do từ 0,1 đến 0,2 mg/L tại vòi sử dụng. Một ngày, nhà máy phải cung cấp 3 000 m3 nước xử lí, thì lượng chlorine cần dùng là bao nhiêu? Câu 12: Rong biền, còn gọi là tảo bẹ, loài sinh vật sống dưới biền, được xem là nguồn thực phầm có giá trị dinh dưỡng cao cho con người. Rong biền khô cung cấp đường, chất xơ, đạm, vitamin A, vitamin B2 và muối khoáng. Trong đó, thành phần được quan tâm hơn cả là nguyên tố vi lượng iodine. Trung bình, trong 100 gam tảo bẹ khô có chứa khoảng 1 000 μg iodine. Để sản xuất 1 tấn iodine thì cần bao nhiêu tấn tảo bẹ khô? BÀI 18: HYDROGEN HALIDE VÀ MỘT SỐ PHẢN ỨNG CỦA ION HALIDE Vận dụng: Câu 1: Hoàn thành phương trình hóa học của các phản ứng sau: (1) NaOH + HCl → (2) Zn + HCl → (3) CaO + HBr → (4) K2CO3 + HI → Câu 2: Viết phương trình hóa học của phản ứng xảy ra trong các trường hợp: a) Kim loại Mg phản ứng với dung dịch HBr Trang 14 TỔ HÓA- SINH NH: 2022-2023 b) Dung dịch KOH phản ứng với dung dịch HCl c) Muối CaCO3 phản ứng với dung dịch HCl d) Dung dịch AgNO3 phản ứng với dung dịch CaI2 Câu 3: Trong phòng thí nghiệm, một khí hydrogen halide (HX) được điều chế theo phản ứng sau: t0 NaXkhan + H2SO4,đặc → HX↑ + NaHSO4 (hoặc Na2SO4) a) Cho biết HX là chất nào trong các chất sau: HCl, HBr, HI. Giải thích. b) Có thể dụng dung dịch NaX và H2SO4 loãng để điều chế HX theo phản ứng trên được không. Giải thích Vận dụng cao: Câu 1: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn 0 thu được 4,48 lít khí H2 (ở đkc và 0 C) và m gam chất rắn không tan. Tìm giá trị của m? Câu 2: Cho 20 gam hỗn hợp bột Mg và Fe tác dụng với dung dịch HCl dư thấy có 1 gam khí H2 bay ra. Tính khối lượng muối clorua tạo ra trong dung dịch? Câu 3: Cho 37,6 gam hỗn hợp gồm CaO, CuO và Fe2O3 tác dụng vừa đủ với 0,6 lít dung dịch HCl 2M, rồi cô cạn dung dịch sau phản ứng thu được m gam muối khan. Tìm giá trị của m? Câu 4: Cho từ từ đến hết 10 g dung dịch X gồm NaF 0,84% và NaCl 1,17% vào dung dịch AgNO 3 dư, thu được m g kết tủa. Tính giá trị của m? Câu 5: Cho m gam X gồm Fe, FeO, Fe3O4, Fe2O3 vào 400 ml dung dịch HCl 2M, sau phản ứng thu được 2,24 lít H2 (ở đktc), dung dịch Y, và 2,8 gam Fe không tan. Tìm giá trị của m? Câu 6: Để trung hòa 200ml dung dịch NaOH 1,5M cần dùng V(l) dung dịch HCl 0,5M. Tìm giá trị của V? 0 Câu 7: Nung 17,55 gam NaCl với H2SO4 đặc, dư thu được V lít khí ở điều kiện chuẩn và 0 C (biết hiệu suất của phản ứng là H= 90%). Tìm giá trị của V? Câu 8: Để hoà tan hoàn toàn một hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 1M, thu được 12,70 gam FeCl2. Tìm giá trị của V? Câu 9: Cho 2,13 gam hỗn hợp X gồm ba kim loại Mg, Cu và Al ở dạng bột tác dụng hoàn toàn với oxygen thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Cho V(l) dung dịch HCl 2M vừa đủ để phản ứng hết với Y. Tìm giá trị của V? Câu 10: Đặt cốc thuỷ tinh lên cân, chỉnh cân về số 0, rót vào cốc dung dịch HCl 1 M đến khối lượng 100 g. Thêm tiếp 1 lượng bột magnesium vào cốc, khi không còn khi thoát ra, cân thể hiện giá trị 105,5 g. a) Khối lượng magnesium thêm vào là bao nhiêu? b) Tinh khối lượng muối và thể tích khí hydrogen (đkc, ở 00C) được tạo ra. Câu 11: “Muối i-ốt” có thành phần chính là sodium chloride (NaCI) có bồ sung một lượng nhỏ potassium iodide (KI) nhằm bồ sung nguyên tố vi lượng iodine cho cơ thề, nhằm ngăn bệnh bửu cồ, phòng ngừa khuyết tật trí tuệ và phát triển,... Trong 100 g muối i-ốt có chứa hàm lượng ion iodide dao động từ 2 200 μg - 2500 μg; lượng iodide cần thiết cho một thiếu niên hay người trưởng thành từ 66 μg - 110 μg/ngày. Trung bình, một thiếu niên hay trưởng thành cần bao nhiêu g muối i-ốt trong một ngày? Câu 12: Trong chế độ dinh dưỡng của trẻ sơ sinh và trẻ nhỏ rất chú trọng thành phần sodium chloride (NaCl) trong thực phầm. Theo khuyến cáo của Tồ chức Y tế thế giới (WHO), lượng muối cần thiết trong 1 ngày đối với trẻ sơ sinh là 0,3 g, với trẻ dưới 1 tuồi là 1,5 g, dưới 2 tuổi là 2,3 g. Nếu trẻ ăn thừa muối sê ảnh hưởng đến hệ Câu tiết, thận, tăng nguy cơ còi xương,... Trẻ ăn thừa muối có xu hướng ăn mặn hơn bình thường và là một trong những nguyên nhân làm tăng huyết áp, suy thận, ung thư khi trưởng thành, ờ từng nhóm tuồi trên, tính lượng lon chloride trong NaCl cho cơ thề mỗi ngày. Trong chế độ dinh dưỡng của trẻ sơ sinh và trẻ nhỏ rất chú trọng thành phần sodium chloride (NaCl) trong thực phầm. Theo khuyến cáo của Tồ chức Y tế thế giới (WHO), lượng muối cần thiết trong 1 ngày đối với trẻ sơ sinh là 0,3 g, với trẻ dưới 1 tuồi là 1,5 g, dưới 2 tuổi là 2,3 g. Nếu trẻ ăn thừa muối sê ảnh hưởng đến hệ Câu tiết, thận, tăng nguy cơ còi xương,... Trẻ ăn thừa muối có xu hướng ăn mặn hơn bình thường và là một trong những nguyên nhân làm tăng huyết áp, suy thận, ung thư khi trưởng thành, ờ từng nhóm tuồi trên, tính lượng lon chloride trong NaCl cho cơ thề mỗi ngày. Câu 13: Ninh Thuận là tỉnh có 3 trong số 7 đồng muối lớn của cả nước là Cà Ná, Tri Hải và Đầm Vua, sản lượng muối của Ninh Thuận chiếm khoảng 50% sản lượng muối cả nước. Nghề làm muối truyền thống có quy trình: cải tạo ô ruộng muối, dẫn nước biền vào, phơi nắng đề nước biền bốc hơl và thu hoạch muối. Sản lượng muối hằng năm đạt hơn 426 500 tấn (giai đoạn 2021 - 2025), tăng trưởng 650 000 tấn (đến năm 2030) đảm bảo Trang 15 TỔ HÓA- SINH NH: 2022-2023 cho yêu cầu phát triền công nghiệp, tạo việc làm cho lực lượng lao động địa phương (theo Thông tấn xã Việt Nam). Nước biền từ biển và đại dương có độ mặn khoảng 3,5% (độ mặn không đồng nhất trên toàn cầu, phần lớn từ 3,1 - 3,8%), với khối lượng riêng 1,02 - 1,03 g/mL, nghĩa là mỗi lít nước biển có khoảng 36 g muối. Độ mặn được tính bằng tồng lượng (đơn vị gam) hoà tan của 11 ion chính (chiếm 99,99%) là: Na+, Ca2+, Mg2+, Fe3+, + - 2- - 2- - - - + NH4 , Cl , SO4 , HCO3 , CO3 , NO2 , NO3 có trong 1 kg nước biển, trong đó ion Cl (55,04%), Na 2- 2+ (30,61%), SO4 (7,68%) và Mg (3,69%). a) Đề khai thác được sản lượng 426 500 tấn/ năm như hiện tại và 650 000/ năm (đến năm 2030) thì thề tích nước biền cần dẫn vào ruộng muối là bao nhiêu? (Tính toán nhằm cung cấp số liệu để tính diện tích ruộng muối, từ đỏ xây dựng quy trình sản xuất đề đạt năng suất cao hơn,...) b) Tính khối lượng ion chloride được khai thác từ nước biền hàng năm. Hết Trang 16
File đính kèm:
 de_cuong_on_tap_kiem_tra_cuoi_ki_ii_hoa_hoc_10_bai_13_18_nam.docx
de_cuong_on_tap_kiem_tra_cuoi_ki_ii_hoa_hoc_10_bai_13_18_nam.docx

