Đề cương ôn thi học kì II Hóa học 10 - Chương 4-7 - Ngân Kiều (Có ma trận)
Bạn đang xem 20 trang mẫu của tài liệu "Đề cương ôn thi học kì II Hóa học 10 - Chương 4-7 - Ngân Kiều (Có ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn thi học kì II Hóa học 10 - Chương 4-7 - Ngân Kiều (Có ma trận)
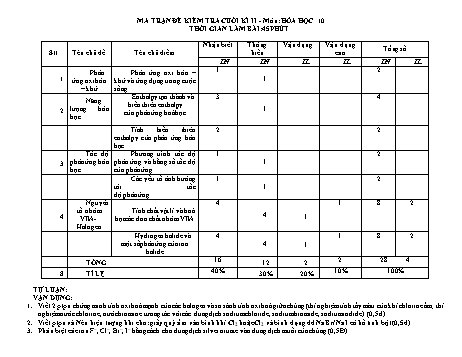
MA TRẬN ĐỀ KIỂM TRA CUỐI KÌ II - Môn: HÓA HỌC 10 THỜI GIAN LÀM BÀI:45 PHÚT Nhận biết Thông Vận dụng Vận dụng Tổng số Stt Tên chủ đề Tên chủ điểm hiểu cao TN TN TL TL TN TL Phản Phản ứng oxi hóa – 1 2 1 ứng oxi hóa khử và ứng dụng trong cuộc 1 – khử sống Enthalpy tạo thành và 3 4 Năng biến thiên enthalpy lượng hóa 1 2 của phản ứng hoá học học Tính biến thiên 2 2 enthalpy của phản ứng hóa học Tốc độ Phương trình tốc độ 1 2 3 phản ứng hóa phản ứng và hằng số tốc độ 1 học của phản ứng Các yếu tố ảnh hưởng 1 2 tới tốc 1 độ phản ứng Nguyên 4 1 8 2 tố nhóm Tính chất vật lí và hoá 4 4 VIIA- học các đơn chất nhóm VIIA 1 Halogen Hydrogen halide và 4 1 8 2 một số phản ứng của ion 4 1 halide TỔNG 16 12 2 2 28 4 8 TỈ LỆ 40% 30% 20% 10% 100% TỰ LUẬN: VẬN DỤNG: 1. Viết 2 ptpu chứng minh tính oxi hoá mạnh của các halogen và so sánh tính oxi hoá giữa chúng (thí nghiệm tính tẩy màu của khí chlorine ẩm; thí nghiệm nước chlorine, nước bromine tương tác với các dung dịch sodium chloride, sodium bromide, sodium iodide). (0,5đ) 2. Viết ptpu và Nêu hiện tượng khi cho: giấy quỳ ẩm vào bình khí Cl2 hoặc Cl2 và bình đựng dd NaBr/ NaI có hồ tinh bột (0,5đ) 3. Phân biệt các ion F–, Cl–, Br–, I– bằng cách cho dung dịch silver nitrate vào dung dịch muối của chúng (0,5Đ) 4. BT dựa trên phương trình hoá học của phản ứng tự oxi hoá – khử của chlorine trong phản ứng với dung dịch sodium hydroxide ở nhiệt độ thường. (0,5Đ) VẬN DỤNG CAO: 1. BT hỗn hợp lập hệ khi cho AgNO3 td hh NaCl, BaBr. (0,5Đ) 2. Giải thích các ứng dụng của một số hydrogen halide (0,5Đ) ĐỀ CƯƠNG ÔN THI HK2 HÓA 10 CHƯƠNG 4 : PHẢN ỨNG OXI HÓA KHỬ BÀI MỨC ĐỘ CÂU HỎI Phản ứng oxi BIẾT (1) Câu 1. Điền vào chỗ trống: hoá – khử Nêu được khái Số oxi hóa của một nguyên tử trong phân tử là (1) .của nguyên tử nguyên tố đó nếu giả định cặp niệm số oxi hoá electron chung thuộc hẳn về nguyên tử của nguyên tố có (2) .lớn hơn. - Nêu được khái A. (1) điện tích, (2) độ âm điện. niệm về phản ứng B. (1) độ âm điện, (2) điện tích. oxi hoá – khử và ý C. (1) electron, (2) độ âm điện. nghĩa của phản ứng D. (1) độ âm điện, (2) electron. oxi hoá – khử Câu 2. Chất khử là chất: A. Cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng. B. Cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng. C. Nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng. D. Nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng. Câu 3. Chất oxi hóa là chất: A. Cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng. B. Cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng. C. Nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng. D. Nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng. Câu 4. Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa - khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử? A. Số mol. B. Số oxi hóa . C. Số khối. D. Số proton . Câu 5. Phát biểu nào sau đây là đúng nhất ? A. Phản ứng oxi hóa -khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng hay phản ứng oxi hóa -khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của nguyên tố hóa học. B. Phản ứng oxi hóa- khử là sự trao đổi hai hay nhiều chất ban đầu để tạo thành chất mới. C. Phản ứng oxi hóa- khử là phản ứng hóa học trong đó các chất phản ứng với nhau sinh ra nhiều chất mới trong đó có sự thay đổi số oxi hóa. D. Phản ứng oxi hóa- khử là quá trình trao đổi electron giữa các nguyên tử của các nguyên tố trong các chất phản ứng với nhau. HIỂU (1) Câu 6. Trong phản ứng dưới đây, vai trò của H2S là. xác định được số 2FeCl3 + H2S → 2FeCl2 + S + 2HCl oxi hoá của nguyên A. Chất oxi hóa. B. chất khử. C. Axit. D. Vừa oxi hóa vừa khử. tử các nguyên tố Câu 7. Cho quá trình . Fe2+ → Fe3++ 1e. Đây là quá trình : trong hợp chất. A. Oxi hóa. B. Khử . C. Nhận proton. D. Tự oxi hóa – khử. Câu 8. Số oxi hóa của S trong phân tử H2SO4 là : A. +2. B. +4. C. +6. D. +8. Câu 9. Số oxi hóa của S trong phân tử Na2S2O3 là: A. 0. B. -2. C. +2. D. +4. Câu 10. Phản ứng nào sau đây là phản ứng oxi hóa – khử ? A. NH3 + HCl NH4Cl B. H2S + 2NaOH Na2S + 2H2O C. H2SO4 + BaCl2 BaSO4 + 2HCl D. 4NH3 + 3O2 2N2 +6H2O Câu 11. Trong phản ứng nào dưới đây HCl thể hiện tính oxi hóa? A. HCl + AgNO3 AgCl+ HNO3 B. 2HCl + Mg MgCl2 + H2 C. 8HCl + Fe3O4 FeCl2 + 2 FeCl3 + 4H2O D. 4HCl + MnO2 MnCl2 + Cl2 + 2H2O CHƯƠNG 5 : NĂNG LƯỢNG HÓA HỌC BÀI MỨC ĐỘ CÂU HỎI Enthalpy BIẾT (3) Câu 1. Phản ứng tỏa nhiệt là gì? tạo thành và - Trình bày được A. Là phản ứng phóng năng lượng dạng nhiệt. biến thiên khái niệm phản ứng B. Là phản ứng hấp thụ năng lượng dạng nhiệt. enthalpy toả nhiệt, thu nhiệt; C. Là phản ứng hấp thụ ion dưới dạng nhiệt. của phản ứng điều kiện chuẩn (áp D. Là phản ứng hấp thụ ion dưới dạng nhiệt. hoá học suất 1 bar và thường Câu 2. Thế nào là phản ứng thu nhiệt? chọn nhiệt độ 25oC A. Là phản ứng phóng năng lượng dạng nhiệt. hay 298 K); B. Là phản ứng hấp thụ năng lượng dạng nhiệt. enthalpy tạo thành C. Là phản ứng hấp thụ ion dưới dạng nhiệt. (nhiệt tạo thành) f D. Là phản ứng hấp thụ ion dưới dạng nhiệt. 0 H 298 và biến thiên Câu 3. Điều kiện chuẩn là điều kiện ứng với enthalpy (nhiệt phản A. áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ ứng) của phản ứng thường được chọn là 298K (25oC). 0 -1 rH 298 B. áp suất 2 bar (đối với chất khí), nồng độ 1 mol L (đối với chất tan trong dung dịch) và nhiệt độ - Nêu được ý nghĩa thường được chọn là 298K (25oC). của dấu và giá trị C. áp suất 1 bar (đối với chất khí), nồng độ 2 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ 0 o rH 298. thường được chọn là 298K (25 C). D. áp suất 2 bar (đối với chất khí), nồng độ 2 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298K (25oC). Câu 4. Phát biểu nào sau đây là sai? A. Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất ở một điều kiện xác định; B. Nhiệt tạo thành chuẩn là nhiệt tạo thành 1 chất ở điều kiện chuẩn; C. Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất có giá trị > 0. D. Biến thiên enthapy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các sản phẩm và tổng nhiệt tạo thành các chất đầu. Câu 5. Kí hiệu của nhiệt tạo thành chuẩn là? 표 표 표 표 A. ∆ H298 B. ∆ H ; C. ∆ H273 D. ∆ H1. Câu 6. Nhiệt kèm theo phản ứng trong điều kiện chuẩn là 표 A. enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ∆ H298; 표 B. biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ∆ H298; 표 C. biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ∆ H298; 표 D. enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của phản ứng đó, kí hiệu là ∆ H298. Câu 7. Phát biểu nào sau đây là ĐÚNG: A. Biến thiên enthalpy của phản ứng là nhiệt tỏa ra hay thu vào ở điều kiện cụ thể. B. Phản ứng thu vào càng nhiều nhiệt, biến thiên enthalpy càng âm. C. Biến thiên enthalpy của 1 phản ứng là nhiệt tỏa ra hay thu vào của phản ứng ở điều kiện chuẩn. D. Độ biến thiên enthalpy của một phản ứng không thay đổi khi nhiệt độ thay đổi. Câu 8. Sự phá vỡ liên kết cần . năng lượng, sự hình thành liên kết .. năng lượng. Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là A. cung cấp, giải phóng; B. giải phóng, cung cấp; C. cung cấp, cung cấp; D. giải phóng, giải phóng. Câu 9. Sự . liên kết cần cung cấp năng lượng, sự liên kết giải phóng năng lượng. Cụm từ thích hợp điền vào chỗ trống: A. hình thành; phá vỡ. B. phá vỡ; hình thành. C. hình thành; hình thành. D. phá vỡ; phá vỡ. Câu 10. Đơn vị của nhiệt tạo thành chuẩn là? A. kJ; B. kJ/mol; C. mol/kJ; D. J. Câu 11. Biến thiên enthalpy chuẩn được xác định ở nhiệt độ nào? A. 0oC; B. 25oC; C. 40oC; D. 100o Câu 12. Phản ứng tỏa nhiệt ở đkc thì o o o o A. ∆rH 298K > 0. B. ∆rH 298K < 0. C. ∆rH 298K ≥ 0. D. ∆rH 298K ≤ 0. Câu 13. Phản ứng thu nhiệt ở đkc thì o o o o A. ∆rH 298K > 0. B. ∆rH 298K < 0. C. ∆rH 298K ≥ 0. D. ∆rH 298K ≤ 0. Câu 14. Biến thiên enthalpy của phản ứng nào sau đây có giá trị âm? A. Phản ứng tỏa nhiệt. B. Phản ứng thu nhiệt. C. Phản ứng oxi hóa – khử. D. Phản ứng phân hủy. Câu 16. Ý nghĩa của enthalpy: A. Xác định hiệu ứng nhiệt phản ứng (nhiệt phản ứng) trong quá trình đẳng áp. B. Xác định hiệu ứng nhiệt phản ứng trong quá trình đẳng áp, đẳng nhiệt. C. Xác định hiệu ứng nhiệt phản ứng trong quá trình đẳng nhiệt. D. Xác định hiệu ứng nhiệt phản ứng trong quá trình phản ứng. 표 Câu 17. Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là ∆ H298, là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn. Khi phản ứng tỏa nhiệt thì 표 표 표 표 A. ∆ H298 0. D. -100 < ∆ H298< 0. Câu 18. Giá trị nhiệt độ và áp suất chất khí được chọn ở điều kiện chuẩn là: A. 273 K và 1 bar.B. 298 K và 1 bar. C. 273 K và 0 bar.D. 298 K và 0 bar. HIỂU (1) Câu 1. Cho các yếu tố sau: Xác định được phản (1) Điều kiện xảy ra phản ứng ; (2) Trạng thái vật lý của các chất ; (3) Số lượng chất tham gia. ứng thu nhiệt hay tỏa Biến thiên enthalpy phụ thuộc vào các yếu tố nào? nhiệt dựa vào A. chỉ có 1 B. chỉ có 2 . C. 1 và 2 D. 1,2, và 3 0 rH 298 Câu 2. Biến thiên enthalpy của một phản ứng được ghi So sánh phản ứng ở sơ đồ dưới đây. Kết luận nào sau đây là đúng? nào xảy ra thuận lợi A. Phản ứng tỏa nhiệt. hơn dựa vào giá trị B. Năng lượng chất tham gia phản ứng nhỏ hơn 0 rH 298 năng lượng sản phẩm. C. Biến thiên enthalpy của phản ứng là a kJ/mol. D. Phản ứng thu nhiệt. Câu 3. Cho phản ứng sau: CaCO3(s) →CaO(s) + 표 CO2(g) có ∆ H298= 178,29 kJ. Phát biểu nào sau đây là đúng? A. Để tạo thành 1 mol CaO thì phản ứng giải phóng một lượng nhiệt là 178,29 kJ. B. Phản ứng trên là phản ứng tỏa nhiệt. C. Phản ứng diễn ra thuận lợi. D. Phản ứng diễn ra không thuận lợi. Câu 4. Cho 2 phương trình nhiệt hóa học sau: 표 C (s) + H2O (g) → CO (g) + H2 (g) ∆푡H298 = +121,25 kJ (1). 표 CuSO4 (aq) + Zn (s) → ZnSO4 (aq) + Cu (s) ∆푡H298 = -230,04 kJ (2). Chọn phát biểu đúng: A. Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng 2 là phản ứng thu nhiệt. B. Phản ứng (1) là phản ứng thu nhiệt, phản ứng 2 là phản ứng tỏa nhiệt. C. Phản ứng (1) và (2) là phản ứng thu nhiệt. D. Phản ứng (1) và (2) là phản ứng tỏa nhiệt. o Câu 5. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: N2 (g) + O2 (g) → 2NO (g) ∆rH 298K = +180 kJ Kết luận nào sau đây là đúng A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp; B. Phản ứng tỏa nhiệt; C. Phản ứng xảy ra thuận lợi hơn ở điều kiện thường; D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường. Câu 6. Chọn phương án đúng: 표 A. ∆ H298> 0, chất kém bền hơn về mặt năng lượng so với đơn chất bền tạo ra nó. 표 B. ∆ H298 > 0, chất kém bền hơn về mặt năng lượng so với đơn chất kém bền tạo ra nó. 표 C. ∆ H298 > 0, chất bền hơn về mặt năng lượng so với đơn chất bền tạo ra nó. 표 D. ∆ H298 > 0, chất bền hơn về mặt năng lượng so với đơn chất kém bền tạo ra nó. Câu 7. Cho phản ứng sau: o S (s) + O2 (g) → SO2 (g) ∆rH 298K(SO2, g)= -296,8kJ/mol. Khẳng định sai là: o A. ∆fH 298K(SO2, g)= -296,8 kJ/mol là lượng nhiệt tỏa ra khi tạo ra 1 mol SO2 (g) từ đơn chất S (s) và O2 (g) ở điều kiện chuẩn. o B. Ở điều kiện chuẩn ∆fH 298K(O2, g)= 0. o C. Ở điều kiện chuẩn ∆fH 298K(S, g)= 0. D. Hợp chất SO2 (g) kém bền hơn về mặt năng lượng so với các hợp chất bền S(s) và O2 (g). Câu 8: Cho phương trình nhiệt hóa của phản ứng: o 2H2 (g) + O2 (g) 2H2O (l) rH 298 -571,68 kJ Phản ứng trên là phản ứng A. thu nhiệt. B. tỏa nhiệt. C. không có sự thay đổi năng lượng. D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh. Câu 9. Cho phương trình nhiệt hóa học của phản ứng t o o N2 (g) + O2 (g) 2NO (g) rH 298 +179,20 kJ Phản ứng trên là phản ứng A. thu nhiệt. B. không có sự thay đổi năng lượng. C. tỏa nhiệt. D. có giải phóng nhiệt lượng ra môi trường xung quanh. Câu 10. Dựa vào phương trình nhiệt hóa học của phản ứng sau: 1 o CO2 (g) CO(g) + O2 (g) H 298 +280 kJ 2 r o Giá trị rH 298của phản ứng 2CO2 (g) 2CO + O2 (g) là A. +140 kJ. B. -1120 kJ. C. +560 kJ. D. -420 kJ. Câu 11. Cho phương trình nhiệt hóa học của phản ứng sau: o C (kim cương) C (graphite) ΔrH298= – 1,9 kJ Chọn phát biểu đúng: A. kim cương bền hơn graphite, phản ứng tỏa nhiệt. B. kim cương bền hơn graphite, phản ứng thu nhiệt. C. graphite bền hơn kim cương, phản ứng tỏa nhiệt. D. graphite bền hơn kim cương, phản ứng thu nhiệt. 표 Câu 12. Cho phản ứng sau: H2(g) + Cl2(k) →2HCl ∆ H298 = -184,6 kJ. Phản ứng trên là A. Phản ứng tỏa nhiệt.B. Phản ứng thu nhiệt. C.Phản ứng thếD. Phản ứng phân hủy. Tính biến BIẾT (2) Câu 1. Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g) thiên enthalpy Biết công thức tính Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là 표 của phản ứng rH298 của một phản A. ∆ H298 = Eb(A)+ Eb(B) - Eb(M) - Eb (N). 표 hóa học ứng dựa vào năng B. ∆ H298 = a × Eb (A) + b × Eb(B) - m × Eb(M) - n × Eb(N). 표 lượng liên kết, nhiệt C. ∆ H298 = Eb(M) + Eb(N) - Eb(A) - Eb(B). 표 tạo thành D. ∆ H298 = m × Eb(M) + n × Eb(N) + a × Eb(A) – b × Eb(B). Câu 2. Tính biến thiên enthalpy của phản ứng theo năng lượng liên kết khi các chất ở trạng thái nào? A. Chất lỏng; B. Chất rắn; C. Chất khí;D. Chất lỏng hoặc khí. Câu 3. Công thức tính biến thiên enthalpy của phản ứng đúng là? 표 표 표 표 표 표 A. ∆ H298=2.∑ ∆ H298 (sp)−∑ ∆ H298 (cđ). B. ∆ H298=∑∆ H298 (cđ)−2.∑ ∆ H298 (sp). 표 표 C. ∆ H298=2.∑Eb(sp)−∑Eb(cđ). D. ∆ H298=∑Eb(cđ)−∑Eb(sp). CHƯƠNG 6 : TỐC ĐỘ PHẢN ỨNG HÓA HỌC BÀI MỨC ĐỘ CÂU HỎI PHƯƠNG BIẾT (1) Câu 1. Có phương trình phản ứng: 2A + B C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu TRÌNH TỐC Viết được biểu thức thức: v = k[A]2.[B]. Hằng số tốc độ k phụ thuộc vào: ĐỘ PHẢN tốc độ phản ứng theo A. Nồng độ của chất B. Nồng độ của chất B. ỨNG VÀ hằng số tốc độ phản C. Nhiệt độ của phản ứng. D. Thời gian xảy ra phản ứng. HẰNG SỐ ứng và nồng độ Câu 2. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O 2(g) → 2NO2(g). Viết biểu thức tốc TỐC DỘ Từ đó nêu được ý độ tức thời của phản ứng: PHẢN ỨNG nghĩa hằng số tốc độ A. Công thức tính tốc độ tức thời của phản ứng là: v1 = k. CNO.CO2 2 phản ứng. B. Công thức tính tốc độ tức thời của phản ứng là: v1 = 2k C NO.CO2 2 C. Công thức tính tốc độ tức thời của phản ứng là: v1 = k. C NO.CO2 2 D. Công thức tính tốc độ tức thời của phản ứng là: v1 = k. CNO.C O2 Câu 4. Thực nghiệm cho biết tốc độ phản ứng A 2 + B2 → 2AB được tính theo biểu thức: v = k.CMA2. CMB2. Trong các điều khẳng định dưới đây, khẳng định nào phù hợp với biểu thức trên ? A. Tốc độ phản ứng hoá học được đo bằng sự biến đổi nồng độ các chất phản ứng trong một đơn vị thời gian. B. Tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng. C. Tốc độ phản ứng giảm theo tiến trình phản ứng. D. Tốc độ phản ứng tăng lên khi có mặt chất xúc tác. Câu 5. Hằng số tốc độ phản ứng phụ thuộc vào những yếu tố nào sau đây ? A. Áp suất. B. Chất xúc tác. C. Nhiệt độ. D. Nồng độ các chất phản ứng. Câu 6. Hệ số nhiệt độ Van’t Hoff γ có ý nghĩa gì? A. Giá trị γ càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng nhỏ; B. Giá trị γ càng lớn thì ảnh hưởng của áp suất đến tốc độ phản ứng càng nhỏ; C. Giá trị γ càng lớn thì ảnh hưởng của nhiệt độ đến tốc độ phản ứng càng mạnh; D. Giá trị γ càng lớn thì ảnh hưởng của áp suất đến tốc độ phản ứng càng mạnh. Câu 6. Hằng số tốc độ phản ứng k có giá trị đúng bằng tốc độ phản ứng khi: A. Nồng độ các chất phản ứng bằng nhau. B. Nồng độ các chất phản ứng bằng nhau và bằng 1M. C. Nồng độ các chất sản phẩm bằng nhau và bằng 1M. D. Khối lượng của các chất phản ứng bằng nhau. HIỂU (1) Câu 1. Cho phản ứng. 2CO (g) + O2 (g) ⟶ 2CO2 (g) Trình bày được khái Với hệ số nhiệt độ Van’t Hoff γ= 2 .Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng niệm tốc độ phản từ 40°C lên 70°C? ứng hoá học A. tăng gấp 2 lần; B. tăng gấp 8 lần; và cách tính tốc độ C. giảm 4 lần; D. tăng gấp 6 lần. trung bình của phản Câu 2. Hệ số nhiệt độ Van’t Hoff của một phản ứng là γ = 3. Tốc độ phản ứng thay đổi như thế nào khi ứng giảm nhiệt độ phản ứng từ 80°C về 60°C? A. giảm 9 lần; B. tăng 3 lần; C. giảm 6 lần; D. tăng 9 lần. Câu 1. Để đánh giá mức độ xảy ra nhanh hay chậm của các phản ứng hoá học người ta dùng đại lượng nào dưới đây? A. Tốc độ cân bằng. B. Tốc độ phản ứng. C. Phản ứng thuận nghich. D. Phản ứng 1 chiều. Câu 2. Tốc độ phản ứng là: A. độ biến thiên nồng độ của một chất phản ứng trong một đơn vị thời gian. B. độ biến thiên nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian. C. độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian. D. độ biến thiên nồng độ của các chất phản ứng trong một đơn vị thời gian. Câu 3. Hoàn thành phát biểu về tốc độ phản ứng sau: "Tốc độ phản ứng được xác định bởi độ biến thiên ...(1)... của ...(2)... trong một đơn vị ...(3)..." A. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thể tích. B. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thời gian. C. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ. D. (1) thời gian, (2) các chất phản ứng, (3) thể tích. Câu 4. Đại lượng đặc trưng cho độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian gọi là A. tốc độ phản ứng. B. cân bằng hóa học. C. tốc độ tức thời. D. quá trình hóa học. 1. Phát biểu nào sau đây đúng? A. Nói chung, các phản ứng hoá học khác nhau xảy ra nhanh chậm với tốc độ khác nhau không đángkể. B. Tốc độ phản ứng là độ biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. C. Tốc độ phản ứng chỉ có trong phản ứng một chiều. D. Tốc độ phản ứng chỉ được xác định theo lý thuyết. 2. Hằng số tốc độ phản ứng k phụ thuộc yếu tố nào sau đây: A. Bản chất chất phản ứng và nhiệt độ. B. Bề mặt tiếp xúc giữa các chất phản ứng C. Nồng độ các chất tham gia phản ứng. D. Chất xúc tác. 3. Cho phản ứng tổng quát sau: aA + bB →mM + nN. Công thức tính tốc độ trung bình 푣 của phản ứng nào sau đây không đúng? Biết ΔC, Δt lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng. 1 ΔC 1 ΔC 1 ΔC 1 ΔC A. 푣 = . Δt B. 푣 = ― . Δt C. 푣 = . Δt D. 푣 = 푛. Δt 3. Cho phản ứng hóa học có dạng: A + B → C. Tốc độ phản ứng thay đổi như thế nào khi nồng độ của A tăng lên 2 lần, nồng độ của B giảm đi 2 lần. A. Tốc độ phản ứng tăng lên 2 lần. B. Tốc độ phản ứng tăng lên 4 lần. C. Tốc độ phản ứng tăng lên 8 lần. D. Tốc độ phản ứng không thay đổi. 4. Cho phản ứng hoá học tổng hợp amonia N2(k) + 3H2(k) 2NH3(k) Khi tăng nồng độ của hiđro lên 2 lần, tốc độ phản ứng thuận. A. giảm đi 2 lần. B. tăng lên 2 lần. C. tăng lên 8 lần. D. tăng lên 6 lần 5. Cho phản ứng: A+ 2B → C. Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4 Tính tốc độ phản ứng lúc ban đầu. A. Vban đầu = 0,1 mol/ls B. Vban đầu = 0,06 mol/ls C. Vban đầu = 0,03 mol/ls D. Vban đầu = 0,4 mol/ls 6. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O 2(g) → 2NO2(g). Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi nồng độ O2 tăng 3 lần, nồng độ NO không đổi? A. v2 bằng so với v1B. v2 tăng 3 lần so với v1 C. v2 tăng 2 lần so với v1D. v2 tăng 4 lần so với v1 7. Cho phản ứng đơn giản xảy ra trong bình kín: 2NO(g) + O 2(g) → 2NO2(g). Ở nhiệt độ không đổi, tốc độ phản ứng thay đổi thế nào khi nồng độ NO và O2 đều tăng 3 lần? A. V2 tăng 3 lần so với v1 B. V2 tăng 9 lần so với v1 C. V2 tăng 27 lần so với v1 D. v2 giảm 27 lần so với v1 CÁC YẾU TỐ BIẾT (1) 1. Phương án nào dưới đây mô tả đầy đủ nhất các yếu tố ảnh hưởng đến tốc độ phản ứng? ẢNH HƯỞNG - Nêu các yếu tố ảnh A. Nồng độ, nhiệt độ, chất xúc tác, áp suất. B. Nồng độ, nhiệt độ, chất xúc tác. ĐẾN TỐC DỘ hưởng đến tốc độ C. Nồng độ, nhiệt độ, chất xúc tác, áp suất, tốc độ khuấy trộn, diện tích bề mặt chất rắn. PHẢN ỨNG phản ứng. D. Nồng độ, nhiệt độ, chất xúc tác, áp suất, tốc độ khuấy trộn, khối lượng chất rắn. HÓA HỌC –Nêu được ý nghĩa 2. Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây: của hệ số nhiệt độ A. Thời gian xảy ra phản ứng B. Bề mặt tiếp xúc giữa các chất phản ứng Van’t Hoff (γ). C. Nồng độ các chất tham gia phản ứng D. Chất xúc tác 3. Cho các yếu tố sau:a. nồng độ chất. b. áp suất. c. xúc tác. d. nhiệt độ. e.diện tích tiếp xúc. Những yếu tố ảnh hưởng đến tốc độ phản ứng nói chung là A. a, b, c, d. B. b, c, d, e. C. a,c, e. D. a,b, c, d, e. 5. Tốc độ phản ứng của chất khí sẽ giảm khi: A. Tăng nồng độ chất tham gia B. Giảm áp suất của chất khí C. Tăng nhiệt độ D. Thêm chất xúc tác. 6. Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây? A. Đốt trong lò kín. B. Xếp củi chặt khít. C. Thổi hơi nước. D. Thổi không khí khô. 7. Cho phản ứng phân huỷ hydrogen peoxit trong dung dịch. 2H2O2 2H2O + O2 Yếu tố ảnh không hưởng đến tốc độ phản ứng là. A. Nồng độ H2O2. B. Thời gian C. Nhiệt độ. D. Chất xúc tác MnO2. 8. Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ ancol (rượu) ? A. Chất xúc tác. B. áp suất. C. Nồng độ. D. Nhiệt độ. 9 Điền và hoàn thiện khái niệm về chất xúc tác sau. "Chất xúc tác là chất làm..(1).. tốc độ phản ứng nhưng..(2).. trong quá trình phản ứng" A. (1) thay đổi, (2) không bị tiêu hao. B. (1) tăng, (2) giảm đi C. (1) tăng, (2) không bị thay đổi. D. (1) thay, (2) bị tiêu hao không nhiều. HIỂU (1) 1. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn Thực hiện được một nhất khi dùng nhôm ở dạng nào sau đây ? số thí nghiệm nghiên A. Dạng viên nhỏ. B. Dạng bột mịn, khuấy đều. C. Dạng tấm mỏng.D. Dạng nhôm dây. cứu các yếu tố ảnh 2. So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như hưởng tới tốc độ nhau). phản ứng (nồng độ, Zn (bột) + dung dịch CuSO4 1M (1) nhiệt độ, áp suất, Zn (hạt) + dung dịch CuSO4 1M (2) diện tích bề mặt, Kết quả thu được là. chất xúc tác). A. (1) nhanh hơn (2). B. (2) nhanh hơn (1). - Giải thích được các C. như nhau. D. ban đầu như nhau, sau đó (2) nhanh hơn(1). yếu tố ảnh hưởng tới 3. Đồ thị dưới đây biểu diễn sự phụ thuộc của tốc độ phản ứng vào nồng độ chất phản ứng như thế nào? tốc độ phản ứng như: nồng độ, nhiệt A. Giảm khi nồng độ của chất phản ứng tăng. độ, áp suất, diện tích B. Không phụ thuộc vào nồng độ của chất phản ứng. bề mặt, chất xúc tác. C. Tăng khi nồng độ của chất phản ứng tăng. D. Tăng khi nồng độ của chất phản ứng giảm. 4. Khi cho cùng một lượng dung dịch axit sunfuric vào hai cốc đựng cùng một thể tích dung dịch Na2S2O3 với nồng độ khác nhau, ở cốc đựng dung dịch Na 2S2O3 có nồng độ lớn hơn thấy kết tủa xuất hiện trước. Điều đó chứng tỏ ở cùng điều kiện về nhiệt độ, tốc độ phản ứng: A. Giảm khi nồng độ của chất phản ứng tăng. B. Không phụ thuộc vào nồng độ của chất phản ứng. C. Tăng khi nồng độ của chất phản ứng tăng. D. Tăng khi nồng độ của chất phản ứng giảm. 5. Nhận định nào dưới đây là đúng? A. Nồng độ chất phản ứng tăng thì tốc độ phản ứng tăng. B. Nồng độ chất phản ứng giảm thì tốc độ phản ứng tăng. C. Nồng độ chất phản ứng tăng thì tốc độ phản ứng giảm. D. Sự thay đổi nồng độ chất phản ứng không ảnh hưởng đến tốc độ phản ứng. 6. Đối với các phản ứng có chất khí tham gia, khi tăng áp suất, tốc độ phản ứng tăng là do A. Nồng độ của các chất khí tăng lên. B. Nồng độ của các chất khí giảm xuống. C. Chuyển động của các chất khí tăng lên. D. Nồng độ của các chất khí không thay đổi. o 8. Cho 5 gam kẽm viên vào cốc đựng 50 ml dung dịch H2SO4 4M ở nhiệt độ thường (25 C). Trường hợp nào tốc độ phản ứng không đổi ? A. Thay 5 gam kẽm viên bằng 5 gam kẽm bột. B. Thay dung dịch H2SO4 4M bằng dung dịch H2SO4 2M. C. Tăng nhiệt độ phản ứng từ 25oC đến 50oC. D. Dùng thể tích dung dịch H2SO4 gấp đôi ban đầu 11. Thực hiện 2 thí nghiệm theo hình vẽ sau. Ở thí nghiệm nào có kết tủa xuất hiện trước? A. TN1 có kết tủa xuất hiện trước. B. TN2có kết tủa xuất hiện trước. C. Kết tủa xuất hiện đồng thời. D. Không có kết tủa xuất hiện 12. Nội dung nào thể hiện trong các câu sau đây là sai ? A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất. B. Nước giải khát được nén CO2 vào ở áp suất cao hơn sẽ có độ chua (độ axit) lớn hơn. C. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn. D. Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong không khí. Câu 14. nước ta, nghề nấu rượu thủ công đã có từ ngàn xửa và hiện nay đã phát triển thành các làng nghề có tiếng như rượu làng Vân. Rượu được nấu bằng phương pháp lên men. Tinh bột (gạo, ngô, khoai, sắn..) được nấu chín để nguội, sau đó rắc lên một lớp men rồi đem ủ. Sau khoảng 10 – 20 ngày (tùy thời tiết) đem chưng cất thu được rượu. Yếu tố nào đã được sử dụng để tăng tốc độ phản ứng theo cách làm trên? A. Nhiệt độ. B. Xúc tác.C. Nồng độ D. Áp suất. Câu 15. Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia? A. Chất lỏng. B. Chất rắn. C. Chất khí. D. Hơi Câu 16. Hai nhóm học sinh làm thí nghiệm: nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch hydrochloric acid (HCl) Nhóm thứ nhất: Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch axit HCl 2M. Nhóm thứ hai: Cân 1g bột kẽm và thả vào cốc đựng 300 ml dung dịch axit HCl 2M. Kết quả cho thấy bọt khí thoát ra ở thí nghiệm của nhóm thứ hai mạnh hơn là do A. nhóm thứ hai dùng nhiều axit hơn. B. diện tích bề mặt bột kẽm lớn hơn. C. nồng độ kẽm bột lớn hơn. D. áp suất lớn hơn Câu 17. Trong công nghiệp người ta điều chế NH3 theo phương trình hóa học. N2(k)+3H2(k)→←2NH3(k). Khi tăng nồng độ H 2 lên ba lần (giữ nguyên nồng độ của N 2 và nhiệt độ phản ứng) thì tốc độ phản ứng thay đổi thế nào? A. Giảm đi. B. Tăng lên. C. Không thay đổi. D. Tăng rồi giảm. 푡0 Câu 18. Cho phản ứng hóa học: A(g)+2B(g) AB2(g) Tốc độ phản ứng sẽ tăng khi A. tăng áp suất. B. tăng thể tích của bình phản ứng. C. giảm áp suất. D. giảm nồng độ của A. Câu 19. Người ta sử dụng các biện pháp sau để tăng tốc độ phản ứng: -Dùng khí nén, nóng thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang). -Nung đá vôi ở nhiệt độ cao để sản xuất vôi sống. -Nghiền nguyên liệu trước khi nung để sản xuất clanhke. -Cho bột sắt làm xúc tác trong quá trình sản xuất NH3 từ N2 và H2. Trong các biện pháp trên, có bao nhiêu biện pháp đúng? A. 1 B. 2 C. 3 D. 4 Câu 20. Để thu khí O2 theo phản ứng: 2H2O2 →2H 2O + O2. Có 3 cốc chứa 20ml dung dịch H2O2 cùng nồng độ. Tiến hành 3 thí nghiệm như hình vẽ sau. Ở thí nghiệm nào có bọt khí thoát ra chậm nhất? A. Thí nghiệm1 B. Thí nghiệm 2 C. Thí nghiệm 3 D. 3 thí nghiệm như nhau Câu 21. Cho 2 mẫu BaSO3 có khối lượng bằng nhau và 2 cốc chứa 50ml dung dịch HCl 0,1M như hình sau. Hỏi ở cốc nào mẫu BaSO3 tan nhanh hơn? A. Cốc 1 tan nhanh hơn. B. Cốc 2 tan nhanh hơn. C. Tốc độ tan ở 2 cốc như nhau. D. BaSO3 tan nhanh nên không quan sát được. NGÂN HÀNG CÂU HỎI CHƯƠNG 7 : NGUYÊN TỐ NHÓM VII A – HALOGEN NỘI DUNG CÂU HỎI Bài Mức độ đánh giá 1. Nguyên tố nào sau đây không phải là nguyên tố halogen? Tính A. Fluorine.B. Bromine. C. Oxygen. D. Iodine. chất 2. Hàm lượng nguyên tố halogen nhiều nhất trong tự nhiên: vật lí MĐ BIẾT:(4) A. Fluorine.B. Bromine. C. Chlorine. D. Iodine. và hoá – Phát biểu được 3. Khoáng chất không chứa fluorine là : học các trạng thái tự nhiên của A. cryolite. B.fluorapatite C. fluorite D. sylvite đơn các nguyên tố halogen. 4.Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể lỏng? chất A. F2.B. Cl 2.C. Br 2.D. I 2. nhóm 5.Ở điều kiện thường, đơn chất chlorine có màu: VIIA A. Lục nhạt.B. Vàng lục.C. Nâu đỏ. D. Tím đen. 6. Phát biểu nào sau đây là không đúng? A. halogen trong tự nhiên tồn tại ở dạng đơn chất. B. Tính oxi hoá của đơn chất halogen giảm dần từ F2 đến I2. C. Khí chlorine ẩm và nước chlorine đều có tính tẩy màu. D. Fluorine có tính oxi hoá mạnh hơn chlorine. 8. Đi từ fluorine đến iodine, nhiệt độ sôi của các đơn chất halogen biến đổi như thế nào? A. Tăng dần.B. Giảm dần. C. Không thay đổi. D. Không xác định được. 9. Đâu là mô tả đúng về đơn chất halogen Cl2? HIỂU (4) A. Thăng hoa khi đun nóng.B. Chất khí, màu vàng lục. C. Oxi hóa được nước. D. Chất lỏng, màu nâu đỏ. – Mô tả được 10. Đâu là mô tả đúng về đơn chất halogen Br2? trạng thái, màu sắc, A. Thăng hoa khi đun nóng.B. Dùng để sản xuất nước Javel. nhiệt độ nóng chảy, C. Oxi hóa được nước.D. Chất lỏng, màu nâu đỏ. nhiệt độ sôi của các đơn 11. Đâu là mô tả đúng về đơn chất halogen I2? chất halogen. A. Thăng hoa khi đun nóng.B. Dùng để sản xuất nước Javel. C. Oxi hóa được nước. D. Chất lỏng, màu nâu đỏ. 12. Đâu không phải là TÍNH CHẤT CHUNG của các Halogen? A. Đều là chất khí ở điều kiện thường. B. Đều có tính oxi hóa. C. Tác dụng với nhiều kim loại . D. Khả năng tác dụng với H2O giảm dần từ F2 tới I2. 13. Cho những thông tin sau, có bao nhiêu thông tin đúng về các nguyên tố nhóm halogen? (1) Ở nhiệt độ 200C, fluorine và bromine tồn tại ở thể khí. (2) Cấu hình electron lớp ngoài cùng của các halogen F, Cl, Br, I theo thứ tự lần lượt là 5s25p5, 2s22p5, 4s24p5, 3s23p5. (3) Từ fluorine đến iodine, nhiệt độ sôi và nhiệt độ nóng chảy tăng dần. (4) Ở nhiệt độ 200C, fluorine và chlorine tồn tại ở thể khí. A. 1.B. 2. C. 3. D. 4. 14. Khi nung nóng, iodine rắn chuyển ngay thành hơi, không qua trạng thái lỏng. Hiện tượng này được gọi là A. Sự thăng hoa. B. Sự bay hơi. C. Sự phân hủy. D. Sự ngưng tụ. 15. Chọn phát biểu đúng: Từ F2 đến I2 A. nhiệt độ nóng chảy tăng dần, nhiệt độ sôi giảm dần. B. nhiệt độ nóng chảy giảm dần, nhiệt độ sôi tăng dần. C. nhiệt độ nóng chảy, nhiệt độ sôi tăng dần. D. nhiệt độ nóng chảy, nhiệt độ sôi giảm dần. HIỂU 16. Chọn phát biểu sai: Giải thích được sự biến A. Nhiệt độ nóng chảy và nhiệt độ sôi của đơn chất halogen bị ảnh hưởng bởi tương tác Van Der Waals đổi nhiệt độ nóng chảy, giữa các phân tử. nhiệt độ sôi của các đơn B. Từ Fluorine đến Iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác Van Der chất halogen dựa vào Waals, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi tăng tương tác Van Der C. Từ F2 đến I2 , màu sắc đậm dần. Waals D. Từ F2 đến I2 , nhiệt độ nóng chảy của F2 cao nhất. 17. Đi từ fluorine đến iodine, bán kính nguyên tử của các nguyên tố như thế nào? A. Tăng dần.B. Giảm dần. C. Không thay đổi. D. Tăng sau đó giảm dần. 18. Nhận định nào sau đây không đúng về xu hướng biến đổi tính chất từ fluorine đến iodine? A. Khối lượng phân tử tăng dần. B. Tương tác van der Waals giữa các phân tử tăng dần. C. Nhiệt độ sôi tăng dần. D. Độ âm điện tăng dần. 19. Trong bảng tuần hoàn, nguyên tố halogen là các nguyên tố Ở nhóm nào? A. IA.B. IIA. C. VIA. D. VIIA. 20. Nguyên tử của các nguyên tố halogen đều có cấu hình electron lớp ngoài cùng dạng A. ns2np5.B. ns 2np4.C. ns 2. D. ns2np6. 21. Đặc điểm nào dưới đây không phải là đặc điểm chung cho các ngtố halogen (F, Cl, Br, I)? HIỂU A. Lớp electron ngoài cùng đều có 7 electron. B. Nguyên tử đều có khả năng nhận thêm 1 electron. – Trình bày được C. Chỉ có số oxi hóa -1 trong các hợp chất. D. Các hợp chất với hidro đều là hợp chất cộng hóa trị. xu hướng nhận thêm 1 electron (từ kim loại) 22. Khi tác dụng với kim loại, các nguyên tử halogen thể hiện xu hướng nào sau đây? hoặc dùng chung electron (với phi kim) A. Nhường 1 electron. B. Nhận 1 electron. C. Nhường 7 electron. D. Góp chung 1 electron. để tạo hợp chất ion hoặc hợp chất cộng hoá 23. Cho các phát biểu sau: trị dựa theo cấu hình (1) Nguyên tử halogen chỉ nhận thêm electron khi pứng với các chất khác để tạo liên kết hóa học. electron. (2) Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn. (3) Hóa trị phổ biến của các halogen là VII. (4) Trong hợp chất với kim loại, halogen có số oxi hóa -1. (5) Khi đơn chất halogen phản ứng với một số phi kim sẽ tạo hợp chất có liên kết cộng hóa trị. Trong các phát biểu trên, số phát biểu đúng là: A. 1B. 2C. 3 D. 4. 24. Trong phản ứng clo với nước, clo là chất: A. oxi hóa. B. khử C. vừa oxi hóa, vừa khử. D. không oxi hóa, khử. 25. Đi từ fluorine đến iodine, độ âm điện của các nguyên tử nguyên tố như thế nào? A. Tăng dần.B. Giảm dần. C. Tăng sau đó giảm dần. D. Giảm sau đó tăng dần. 26. Tính oxi hóa trong nhóm Halogen thay đổi theo thứ tự nào? A. F > Cl > Br > I B. F Cl > I > Br D. F < Cl < I < Br 27. Sắp xếp theo chiều tăng tính oxi hóa của các nguyên tử là: A. I, Cl, Br, F B. Cl, I, F, Br. C. I, Br, Cl, F D. I, Cl, F, Br 28. Phản ứng giữa hydrogen và chất nào sau đây thuận nghịch? A. F2. B. Cl2. C. I2. D. Br2. HIỂU 29. Chọn phát biểu đúng. Thực hiện được (hoặc A. Từ fluorine đến iodine, tính oxi hóa giảm dần. quan sát video) thí B. Mức độ phản ứng với hydrogen tăng dần từ fluorine đến iodine. nghiệm chứng minh C. Độ bền nhiệt của các phân tử tăng từ HF đến HI. được xu hướng giảm D. Phản ứng hydrogen và iodine là phản ứng một chiều, cần đun nóng dần tính oxi hoá của các 30. Cho clo vào nước, thu được nước clo. Biết clo tác dụng không hoàn toàn với nước. Nước clo là hỗn hợp halogen thông qua một gồm các chất : số phản ứng: Thay thế A. HCl, HClOB. HClO, Cl 2, H2O C. H2O, HCl, HClO C. H2O, HCl, HClO, Cl2 halogen trong dung 31. Đâu là mô tả đúng về đơn chất halogen F2? dịch muối bởi một A. Thăng hoa khi đun nóng.B. Dùng để sản xuất nước Javel. halogen khác; Halogen C. Oxi hóa được nước. D. Chất lỏng, màu nâu đỏ. tác dụng với hydrogen 32. Dung dịch Br2 có thể phản ứng được với dung dịch nào sau đây? và với nước. A. NaF.B. NaCl. C. NaBr. D. NaI. 33. Hiện tượng quan sát được khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu là: A. Tạo ra dung dịch màu tím đen. B. Tạo ra dung dịch màu vàng tươi. C. Thấy có khí thoát ra. D. Tạo ra dung dịch màu vàng nâu. 34. Phương trình hóa học nào dưới đây là không chính xác? 푠 A. H2 + Cl2 2HCl. B. Cl2 + 2NaBr 2NaCl + Br2. 1000 C. Cl2 + 6KOHđặc 5KCl + KClO3 + 3H2O. D. I2 + 2KCl 2KI + Cl2. 35. Tính tẩy màu của nước chlorine là do: A. HClO có tính oxi hóa mạnh. B. Cl2 có tính oxi hóa mạnh. C. HCl là acid mạnh. D. HCl có tính khử mạnh. HIỂU 37. Halogen phản ứng mãnh liệt với hydrogen ngay cả trong bóng tối là – Giải thích được A. F2. B. Cl2. C. Br2. D. I2. xu hướng phản ứng của 38. Điều kiện Br2 pứ với H2 là : các đơn chất halogen A. phản ứng mãnh liệt ngay cả trong bóng tối và nhiệt độ thấp. với hydrogen theo khả B. ánh sáng. C. Đun nóng. D. Có xúc tác và nhiệt độ trên 5000C. năng hoạt động của 39. Halogen phản ứng với hydrogen ở nhiệt độ 300-5000C, có xúc tác và phản ứng thuận nghịch là halogen và năng lượng A. F2. B. Cl2. C. Br2. D. I2. liên kết H–X (điều kiện phản ứng, hiện tượng phản ứng và hỗn hợp chất có trong bình phản ứng). 41. Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, vệ sinh gia dụng? A. NaCl.B. NaOH hoặc KOH. C. HCl hoặc NaCl. D. MgCl 2. 42. Hòa tan khí Cl2 vào dung dịch KOH đặc, nóng, dư thu được dung dịch chứa các chất thuộc dãy nào sau đây? A. KCl, KClO3, Cl2 B. KCl, KClO, KOH C. KCl, KClO3, KOH D. KCl, KClO3 43. Hòa tan khí Cl2 vào dung dịch NaOH loãng, dư ở nhiệt độ phòng thu được dung dịch chứa các chất A. NaCl, NaClO , Cl B. NaCl, NaClO, NaOH C. NaCl, NaClO , NaOH D. NaCl, NaClO HIỂU 3 2 3 3 44. Khi tiến hành các thí nghiệm sau, phản ứng trong thí nghiệm nào là phản ứng tự oxi hóa, tự khử? – Viết được A. Đốt cháy Fe trong khí Cl2. B. Dẫn khí Cl2 vào dung dịch NaOH. phương trình hoá học C. Cho khí Cl trộn lẫn với khí H trong bình thủy tinh rồi chiếu tia tử ngoại. của phản ứng tự oxi hoá 2 2 D. Dẫn khí Cl2 qua dung dịch KBr. – khử của chlorine 45. Một bạn học sinh tự thiết kế một thí nghiệm điện phân đơn giản như sau: trong phản ứng với Cho hai lõi bút chì làm hai điện cực và nối với một nguồn điện một chiều 9V và nhúng với dung dịch muối dung dịch sodium ăn (nồng độ 20%) đã khuấy đều. Dung dịch thu được có tính tẩy màu. hydroxide ở nhiệt độ thường và khi đun nóng; ứng dụng của phản ứng này trong sản xuất chất tẩy rửa. Phương trình hóa học điện phân dung dịch muối ăn: đ푖ệ푛 ℎâ푛 2NaCl + 2H2O 2NaOH + H2 + Cl2 Dung dịch thu được có tên gọi là: A. Xút ăn da.B. Nước chlorine. C. Nước Javel. D. Nước muối sinh lý. 46. Nước Gia-ven dùng để tẩy trắng vải, sợi vì có A. Tính khử mạnh. B. Tính tẩy màu mạnh. C. Tính axit mạnh. D. Tính oxi hóa mạnh. 1. Viết ptpu: VẬN DỤNG a/ Cl2 + H2O Thực hiện được (hoặc b/ Br2 + NaCl quan sát video) một số c/ Cl2 + NaBr thí nghiệm chứng minh d/ Cl2 + NaI tính oxi hoá mạnh của e/ Br2 + NaI các halogen và so sánh f/ Br2 + NaCl tính oxi hoá giữa chúng g/ Cl2 td dd NaOH loãng ở nhiệt độ thường. 0 (thí nghiệm tính tẩy h/ Cl2 td dd NaOH loãng ở nhiệt độ > 70 C màu của khí chlorine 1. Viết ptpu, nêu hiện tượng khi cho: ẩm; thí nghiệm nước a/ Giấy quỳ tím ẩm vào bình đựng khí Cl2 chlorine, nước bromine b/ Cho 1ml nước Cl2 vào 2ml dd NaBr. tương tác với các dung c/ Cho 1ml nước Br2 và vài giọt hồ tinh bột vào 2ml dd NaI. dịch sodium chloride, sodium bromide, sodium iodide). d/ Lắp dụng cụ như hình vẽ . Nghiêng ống nghiệm sao cho HCl tiếp xúc KMnO4. 2. Cho 7,437 lít khí Cl2 (đktc) vào dd NaOH loãng dư ở nhiệt độ thường, sau phản ứng thu được dung dịch có chứa m gam NaClO. Tìm giá trị của m. VẬN DỤNG 3. Cho 9,916 lít khí Cl2 (đktc) vào dd NaOH loãng dư ở nhiệt độ thường, sau phản ứng thu được dung dịch có BT dựa trên phương chứa m gam NaClO. Tìm giá trị của m. trình hoá học của 4. Cho 6,1975 lít (đktc) khí Cl2 vào dd NaOH loãng dư ở nhiệt độ thường, sau phản ứng thu được dung dịch có phản ứng tự oxi hoá – chứa m gam NaClO. Tìm giá trị của m. khử của chlorine 5. Cho V lít khí Cl2 vào dd NaOH loãng dư ở nhiệt độ thường, sau phản ứng thu được dung dịch có chứa 8,94 trong phản ứng với gam NaClO. Tìm giá trị của V dung dịch sodium 6. Cho Cl2 pứ vừa đủ 200ml dd NaOH 0,2M (loãng) ở nhiệt độ thường , sau phản ứng thu được dung dịch có hydroxide ở nhiệt độ chứa m gam NaClO. Tìm giá trị của m. thường. (0,5Đ) 7. Cho Cl2 pứ vừa đủ 300ml dd NaOH 0,1M (loãng) ở nhiệt độ thường , sau phản ứng thu được dung dịch có chứa m gam NaClO. Tìm giá trị của m 8. Cho V lít khí Cl2 (đktc) pứ vừa đủ 300ml dd NaOH 0,1M (loãng) ở nhiệt độ thường , sau phản ứng thu được dung dịch có chứa m gam NaClO. Tìm giá trị của m và V. Hydro BIẾT (4) 1. Dung dịch chất nào sau đây được dùng để trung hòa môi trường base, tẩy rửa gỉ sắt (thành phần chính là gen Nêu được ứng dụng của các iron oxide) bám trên bề mặt của các loại thép? halide một số hydrogen halide. A. H2SO4.B. HCl.C. NaOH.D. NaCl. và một 2. Chất nào sau đây dùng khắc hình, khắc chữ lên thủy tinh ? số A. HCl.B. HI. C. HBr. D. HF. phản 3. Dung dịch acid nào sau đây không thể chứa trong bình thuỷ tinh? ứng A. H2SO4 loãngB. HCl loãng của ion C. HF loãngD. H 2SO4 đặc nóng halide 4. Chất dùng để loại bỏ gỉ thép; sản xuất chất tẩy rửa nhà vệ sinh, các hợp chất vô cơ và hữu cơ phục vụ đời sống, sản xuất, là A. HCl.B. HI. C. HBr. D. HF. 5. Chất dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, là A. HCl.B. HI. C. HBr. D. HF. 6. Chất làm chất xúc tác cho các phản ứng hữu cơ, tổng hợp chất chống cháy ,điều chế nhựa epoxy, sản xuất các vi mạch điện tử, là A. HCl.B. HI. C. HBr. D. HF. 7. Thép để lâu ngày trong không khí (đặc biệt là không khí ẩm) thường bị gỉ sét (có thành phần chính là iron oxide). Dung dịch nào sau đây phù hợp để tẩy rửa gỉ sét? A. Dung dịch nước chlorine. B. Dung dịch hydrochloric acid. C. Dung dịch hydrofluoric acid. HIỂU (4) D. Dung dịch cồn iodine. 8. Phát biểu nào sau đây không đúng? – Nhận xét (từ A. Khi sử dụng thực phẩm có lượng acid hoặc kiềm cao, ăn uống và sinh hoạt không điều độ, cuộc sống căng bảng dữ liệu về nhiệt độ thẳng, sẽ làm thay đổi nồng độ HCl trong dạ dày (bao tử) gây bệnh “đau dạ dày”. sôi) và giải thích được B. Hydrofluoric acid có tính ăn mòn thủy tinh. xu hướng biến đổi nhiệt C. Các hydrogen halide khó tan trong nước. độ sôi của các hydrogen D. Nhiệt độ sôi tăng từ HCl đến HI, đó là do khối lượng phân tử và tương tác van der Waals giữa các phân tử halide từ HCl tới HI dựa tăng dần. vào tương tác van der 9. Phát biểu nào sau đây sai? Waals. Giải thích được A. Ở điều kiện thường, hydrogen halide tồn tại ở thể khí, tan tốt trong nước, tạo thành dung dịch hydrohalic sự bất thường về nhiệt acid tương ứng độ sôi của HF so với các B. Từ HCl đến HI, nhiệt độ sôi giảm HX khác. C. HF có nhiệt độ sôi cao bất thường so với HCl là do phân tử HF phân cực mạnh, có khả năng tạo liên kết hydrogen liên phân tử. D. Trong dãy hydrohalic acid, hydroiodic acid là acid mạnh nhất 10. Liên kết trong phân tử hydrogen halide (HX) là? A. Liên kết ionB. Liên kết cho - nhận C. Liên kết cộng hóa trị phân cựcD. Liên kết cộng hóa trị không cực 11. Tại sao hydrogen fluoride có nhiệt độ sôi bất thường so với các hydrogen halide khác? A. Do nguyên tử nguyên tố fluorine có độ âm điện lớn. B. Do giữa các phân tử hydrogen fluoride còn có tương tác van der Waals. C. Do giữa các phân tử hydrogen fluoride còn tạo liên kết hydrogen với nhau. D. Do giữa các phân tử hydrogen fluoride còn tạo liên kết cho – nhận với nhau. 12. HF có nhiệt độ sôi cao bất thường so với HCl, HBr, HI là do A. fluorine có tính oxi hoá mạnh nhất. B. fluorine chỉ có số oxi hoá âm trong hợp chất. C. HF có liên kết hydrogen liên phân tử. D. liên kết H – F phân cực mạnh nhất. HIỂU 9. Sắp xếp theo chiều giảm dần tính acid – Trình bày được A. HCl, HBr, HI, HF. B. HI, HBr, HCl, HF. C. HF, HCl, HBr, HI. D. HBr, HCl, HI, HF. xu hướng biến đổi tính 10. Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào? acid của dãy hydrohalic A. Giảm dần. B. Tăng dần. C. Tăng sau đó giảm dần. D. Giảm sau đó tăng dần. acid. 11. Phát biểu nào sau đây không đúng? A. Khi phản ứng với sulfuric acid đặc thì Cl- không thể hiện tính khử. - - HIỂU B. Khi phản ứng với sulfuric acid đặc thì Br và I thể hiện tính khử. C. Khi phản ứng với sulfuric acid đặc, Br- có tính khử yếu hơn I-. – Trình bày được D. Khi phản ứng với sulfuric acid đặc thì tính khử của ion X- tăng từ I- đến Cl-. tính khử của các ion – – – 12. Chất nào có tính khử mạnh nhất? halide (Cl , Br , I ) A. HFB. HI C. HBr D. HCl thông qua phản ứng với 13. Những hidro halogenua có thể thu được khi cho H2SO4 đặc lần lượt tác dụng với các muối NaF, NaCl, chất oxi hoá là sulfuric NaBr, NaI là acid đặc. HIỂU A. HF, HCl, HBr, HI. B. HF. C. HF, HCl, HBr D. HF, HCl 14. Dung dịch muối nào sau đây tác dụng với dung dịch AgNO3 tạo kết tủa màu trắng? VẬN DỤNG (1Đ) A. NaClB. NaBrC. NaFD. NaI 15. Dung dịch AgNO3không phản ứng với dung dịch nào sau đây? – Thực hiện được A. NaClB. NaIC. NaBrD. NaF thí nghiệm phân biệt các – – – – 16. Để phân biệt các dung dịch: NaF, NaCl, NaBr, NaI, ta dùng ion F , Cl , Br , I bằng A. dung dịch HCl.B. quỳ tím. cách cho dung dịch C. dung dịch BaCl2.D. dung dịch AgNO 3. silver nitrate vào dung 21. Hoá chất dùng để nhận biết 4 dd : NaF, NaCl, NaBr, NaI là dịch muối của chúng. A. NaOH B. H2SO4 C. AgNO3 D. Ag 22. Phân biệt các dung dịch riêng lẻ: a/ HCl, NaCl, NaBr, NaI
File đính kèm:
 de_cuong_on_thi_hoc_ki_ii_hoa_hoc_10_chuong_4_7_ngan_kieu_co.docx
de_cuong_on_thi_hoc_ki_ii_hoa_hoc_10_chuong_4_7_ngan_kieu_co.docx

