Đề cương tự luyện ôn tập cuối học kì 1 Hóa học 10 - Năm học 2022-2023 - Lê Phạm Huyền My (Có đặc tả)
Bạn đang xem tài liệu "Đề cương tự luyện ôn tập cuối học kì 1 Hóa học 10 - Năm học 2022-2023 - Lê Phạm Huyền My (Có đặc tả)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương tự luyện ôn tập cuối học kì 1 Hóa học 10 - Năm học 2022-2023 - Lê Phạm Huyền My (Có đặc tả)
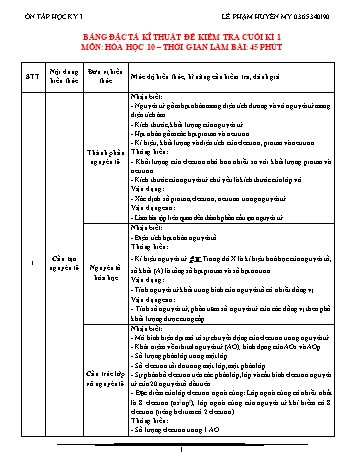
ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA CUỐI KÌ 1 MÔN: HÓA HỌC 10 – THỜI GIAN LÀM BÀI: 45 PHÚT Nội dung Đơn vị kiến STT Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá kiến thức thức Nhận biết: - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. - Kích thước, khối lượng của nguyên tử. - Hạt nhân gồm các hạt proton và neutron. - Kí hiệu, khối lượng và điện tích của electron, proton và neutron. Thành phần Thông hiểu: nguyên tử - Khối lượng của electron nhỏ hơn nhiều so với khối lượng proton và neutron. - Kích thước của nguyên tử chủ yếu là kích thước của lớp vỏ. Vận dụng: - Xác định số proton, electron, neutron trong nguyên tử. Vận dụng cao: - Làm bài tập liên quan đến thành phần cấu tạo nguyên tử. Nhận biết: - Điện tích hạt nhân nguyên tố Thông hiểu: Cấu tạo - Kí hiệu nguyên tử AX. Trong đó X là kí hiệu hoá học của nguyên tố, 1 Z nguyên tử Nguyên tố số khối (A) là tổng số hạt proton và số hạt nơtron. hóa học Vận dụng: - Tính nguyên tử khối trung bình của nguyên tố có nhiều đồng vị Vận dụng cao: - Tính số nguyên tử, phần trăm số nguyên tử của các đồng vị theo phổ khối lượng được cung cấp. Nhận biết: - Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử. - Khái niệm về orbital nguyên tử (AO); hình dạng của AOs và AOp. - Số lượng phân lớp trong một lớp. - Số electron tối đa trong một lớp, một phân lớp. Cấu trúc lớp - Sự phân bố electron trên các phân lớp, lớp và cấu hình electron nguyên vỏ nguyên tử tử của 20 nguyên tố đầu tiên. - Đặc điểm của lớp electron ngoài cùng: Lớp ngoài cùng có nhiều nhất là 8 electron (ns2np6), lớp ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng helium có 2 electron). Thông hiểu: - Số lượng electron trong 1 AO. 1 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 - Quy ước viết cấu hình electron của nguyên tử - Các định số electron lớp ngoài cùng. Vận dụng: - Viết cấu hình electron của nguyên tử - Xác định số electron lớp ngoài cùng. - Xác định loại nguyên tố s, p, d, f dựa vào cấu hình electron nguyên tử. - Dự đoán tính chất của nguyên tố Nhận biết: - Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. - Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố (nhóm A, nhóm B). - Khái niệm liên quan (ô, chu kì, nhóm) Thông hiểu: - Chu kì: là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. Cấu tạo bảng - Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, tuần hoàn d, f). - Mối liên hệ giữa cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn. Vận dụng: - Giải thích được mối liên hệ giữa cấu hình electron và vị trí của nguyên tố trong bảng tuần hoàn, dẫn ra thí dụ minh họa. Vận dụng cao: Bảng tuần - Làm bài tập xác định vị trí của một nguyên tố. hoàn các 2 Xu hướng nguyên tố biến đổi tính Nhận biết: hóa học chất của đơn - Biết được sự biến đổi bán kính nguyên tử trong một chu kì, trong nhóm chất, tính A. chất của hợp - Biết được sự biến đổi tính kim loại, tính phi kim của nguyên tử các chất trong nguyên tố trong một chu kì, trong một nhóm A. một chu kì và trong một nhóm Nhận biết: Định luật - Biết được mối liên hệ giữa vị trí các nguyên tố trong bảng tuần hoàn tuần hoàn và với cấu tạo nguyên tử và ngược lại. ý nghĩa của Thông hiểu: bảng tuần - Mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo hoàn các nguyên tử và tính chất cơ bản của nguyên tố và ngược lại. nguyên tố hóa học 2 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 Nhận biết: - Biết được xu hướng của nguyên tử kim loại khi hình thành liên kết hóa học. - Biết được xu hướng của nguyên tử phi kim khi hình thành liên kết hóa Quy tắc học. octet Thông hiểu: - Hiểu được xu hướng hình thành liên kết của các nguyên tử theo quy tắc octet. - Hiểu được nguyên tử nào thỏa mãn quy tắc octet trong một số phân tử hợp chất . Nhận biết: - Biết được ion, cation, anion, ion đơn nguyên tử, ion đa nguyên tử - Biết được hợp chất nào là hợp chất ion. - Biết được các tính chất của hợp chất ion. Liên kết ion Thông hiểu: - Hiểu được các giai đoạn hình thành hợp chất ion từ các nguyên tử. - Hiểu được tính chất của các hợp chất ion. Vận dụng: - Viết được sự hình thành hợp chất ion từ các nguyên tử. Liên kết Nhận biết: 3 hóa học - Định nghĩa liên kết cộng hoá trị, LKCHT không cực (H2, O2), LKCHT có cực hay phân cực (HCl, CO2). - Biết được công thức Lewis của một số chất đơn giản. - Biết được các loại liên kết (liên kết cộng hoá trị không phân cực, phân cực, liên kết ion) dựa theo độ âm điện. Liên kết Thông hiểu: cộng hóa trị - Dự đoán được kiểu liên kết hoá học có thể có trong phân tử gồm 2 nguyên tử khi biết hiệu độ âm điện của chúng. - Hiểu được sự hình thành liên kết σ và liên kết π qua sự xen phủ AO. Vận dụng cao: - Dựa vào năng lượng liên kết để so sánh được 2 phản ứng, phản ứng nào xảy ra thuận lợi hơn. Nhận biết: - Khái niệm liên kết hydrogen. Liên kết - Vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của H O. hydrogen và 2 Thông hiểu: tương tác - Nhận biết được sự xuất hiện liên kết hydrogen trong một số trường van der hợp điển hình. Waals - Ảnh hưởng của tương tác van der Waals tới nhiệt độ nóng chảy, nhiệt độ sôi của các chất. 3 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 ĐỀ CƯƠNG TỰ LUYỆN ÔN TẬP CUỐI HỌC KÌ 1 KHỐI 10, NĂM HỌC 2022-2023 I. PHẦN TỰ LUẬN Chủ đề 1: Cấu tạo nguyên tử Câu 1: Biết rằng: S (Z = 32), Ca (Z = 20), F (Z = 9), Na (Z = 11)). Hãy hoàn thành những thông tin chưa biết trong bảng sau: KÍ HIỆU NGUYỂN ? ? 65Zn ? ? TỬ 30 Số hiệu nguyên tử ? ? ? 9 11 Số khối ? ? ? ? 23 Số proton 16 ? ? ? ? Số neutron 16 20 ? 10 ? Số electron ? 20 ? ? ? Câu 2: Cho các nguyên tố: Na (Z=11); Al (Z=13); S (Z = 16); Cl (Z=17), Ni (Z = 28), Zn (Z = 30). a). Viết cấu hình electron nguyên tử của các nguyên tố trên. b). Viết cấu hình electron của các ion Na+, Al3+, S2-, Cl-. c). Nhận xét về số electron của các ion dương và ion âm trong trường hợp trên. Câu 3: Trong nguyên tử đồng (copper) có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính số mol mỗi loại đồng vị có trong 6,354 gam đồng. Chủ đề 2: Bảng tuần hoàn các nguyên tố hóa học Câu 4: Cho F (Z = 9), S (Z = 16), Cl (Z = 17). Dãy gồm các phi kim được sắp xếp theo thứ tự tính phi kim giảm dần. Câu 5: Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Hãy cho biết: a) Cấu hình electron của phosphorus. b) Số electron lớp ngoài cùng của nguyên tử phosphorus. c) Phosphorus là kim loại hay phi kim. d) Công thức oxide cao nhất của phosphorus. e) Công thức hợp chất khí của phosphorus với hydrogen. f) Công thức hydroxide cao nhất của phosphorus. g) Oxide và hydroxide cao nhất của phosphorus có tính acid hay base. Câu 6: Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 14. a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn. b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần. c) Xếp các nguyên tố đó theo thứ tự độ âm điện giảm dần. d) Xếp các nguyên tố đó theo thứ tự tính phi kim tăng dần. Câu 7: Tính số electron, viết cấu hình electron và xác đinh vị trí của A, B (ZA < ZB) trong bảng tuần hoàn trong các trường hợp sau: (b) A và B là hai nguyên tố thuộc cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 32. (c) A và B là hai nguyên tố thuộc cùng một nhóm và thuộc hai chu kì liên tiếp trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 52. Câu 8: Hai nguyên tố X và Y ở hai nhóm A liên tiếp trong bảng tuần hoàn, X thuộc nhóm VA. Ở trạng thái đơn chất, X và Y không phản ứng với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. a) Xác định X, Y. b) Viết công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của X, Y và nêu tính chất acid – base của chúng. 4 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 Câu 9: Oxide cao nhất của nguyên tố R có dạng R2O5, được sử dụng làm chất hút ẩm cho chất lỏng và khí. Hợp chất của R với hydrogen ở thể khí có chứa 8,82% hydrogen về khối lượng, là khí rất độc, gây chết với các triệu chứng khó hô hấp, đau đầu, chóng mặt, buồn nôn. a) Xác định công thức phân tử của hợp chất khí của R với hydrogen. b) Nêu vị trí của R trong bảng tuần hoàn. c) Viết cấu hình electron theo ô orbital của nguyên tử R. Câu 10: Một nguyên tố R ở nhóm IIA. Trong hợp chất với oxygen, R chiếm 71,43% về khối lượng. a) Xác định nguyên tử khối của R. b) Cho 16 gam R trên tác dụng hoàn toàn với nước thu được hidroxide. Tính khối lượng hidroxide thu được. Câu 11: Khi cho 8 gam oxide kim loại M thuộc nhóm IIA tác dụng hoàn toàn với dung dịch HCl 20% thu được 19 gam muối chloride. a) Xác định tên kim loại M. b) Tính khối lượng dung dịch HCl 20% đã dùng. Câu 12: Hòa tan 20,2 gam hỗn hợp 2 kim loại nằm ở hai chu kỳ liên tiếp thuộc nhóm IA vào nước thu được 7,437 lít khí hydrogen (điều kiện chuẩn) và dung dịch A. a) Tìm tên hai kim loại. b) Tính thể tích dung dịch H2SO4 2M cần dùng để trung hòa dung dịch A. Chủ đề 3: Liên kết hóa học Câu 13: Hoàn thành thông tin trong bảng sau. 2+ 2- - + - 2- Mg S Br NH4 NO3 SO3 Số proton Số electron Câu 14: Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử: F 2, H2, HF, CH4, NF3, KBr. (Cho số hiệu nguyên tử của F = 9 , H = 1, C = 6, N = 7, K = 19 và Br = 35). Câu 15: Cho các hợp chất sau: K2O, H2O, H2S, SO2, NaCl, K2S, CaF2, HCl. Hợp chất nào trong phân tử có có chứa liên kết ion? Giải thích? Câu 16: Viết cấu hình electron của Cl (Z = 17) và Ca (Z=20). Cho biết vị trí của Ca và Cl (chu kì, nhóm) trong bảng tuần hoàn. Liên kết giữa calcium và chlorine trong hợp chất thuộc loại liên kết gì? Vì sao? Viết sơ đồ hình thành liên kết đó. Bài 17: Nguyên tố X và nguyên tố Y có số đơn vị điện tích hạt nhân lần lượt là 9, 8. a). Viết cấu hình electron nguyên tử của X và Y. Cho biết tính chất hóa học đặc trưng của X và Y. b). Dự đoán liên kết hóa học có thể hình thành giữa X và Y. Viết công thức phân tử của các hợp chất tạo thành. Bài 18: Cho các phân tử sau: Br2, H2S, CH4, NH3, C2H4, C2H2. a). Phân tử nào có liên kết cộng hóa trị không phân cực? Phân tử nào có liên kết cộng hóa trị phân cực? b). Phân tử nào chỉ có liên kết đơn? Phân tử nào có liên kết đôi? Phân tử nào có liên kết ba? II. MỘT SỐ CÂU HỎI TRẮC NGHIỆM KHÁCH QUAN THAM KHẢO Câu 1. Ô nguyên tố không cho biết thông tin nào sau đây? A. Kí hiệu nguyên tố. B. Tên nguyên tố. C. Số hiệu nguyên tử. D. Số khối của hạt nhân. Câu 2. Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về A. khối lượng nguyên tử. B. cấu hình electron. C. số hiệu nguyên tử. D. số khối. 5 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 Câu 3. Chu kì là tập hợp các nguyên tố, mà nguyên tử của các nguyên tố này có cùng: A. số electron.B. số lớp electron. C. số electron hóa trịD. số electron ở lớp ngoài cùng. Câu 4. Electron thuộc lớp nào sau đây liên kết kém chặt chẽ với hạt nhân nhất? A. lớp K. B. lớp L. C. lớp N. D. lớp M. Câu 5. Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là A. 18, 8, 8. B. 18, 8, 10. C. 18, 10, 8. D. 16, 8, 8. Câu 6. Số nguyên tố trong chu kì 3 và 5 là A. 8 và 18. B. 18 và 8. C. 8 và 8. D. 18 và 18. Câu 7. Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo chiều tăng dần từ trái sang phải là? A. F, O, Li, Na. B. Li, Na, O, F. C. F, Na, O, Li. D. F, Li, O, Na. Câu 8. Theo quy luật biến đổi tính chất đơn chất của các nguyên tố trong bảng tuần hoàn thì A. phi kim mạnh nhất là iodine. B. kim loại mạnh nhất là lithium. C. phi kim mạnh nhất là fluorine. D. kim loại yếu nhất là caesium. Câu 9. Nguyên tố A có Z = 10, vị trí của A trong bảng tuần hoàn là? A. chu kì 1, nhóm VIIA B. chu kì 2, nhóm VIIIA C. chu kì 4, nhóm VIA D. chu kì 3, nhóm IVA Câu 10. Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì điều khẳng định nào đúng? A. Bán kính nguyên tử giảm dần. B. Tính phi kim giảm dần. C. Độ âm điện tăng dần. D. Tính kim loại giảm dần. Câu 11. Phát biểu nào sau đây không đúng? A. Trong nguyên tử, các hạt mang điện là electron và proton. B. Nguyên tử của các nguyên tố khác nhau có thể giống nhau về số proton. C. Đồng vị là tập hợp những nguyên tử có cùng số proton, khác nhau về số nơtron. D. Khi nguyên tử nhường eletron sẽ trở thành ion dương. Câu 12. Các nguyên tố thuộc cùng một nhóm A có tính chất hóa học tương tự nhau, vì vỏ nguyên tử của các nguyên tố nhóm A có: A. số electron như nhau. B. số lớp electron như nhau. C. số electron thuộc lớp ngoài cùng như nhau. D. cùng số electron s hay p. Câu 13. Số thứ tự ô nguyên tố trong bảng hệ thống tuần hoàn bằng: A. Số hiệu nguyên tử.B. Số khối. C. Số nơtron. D. Số electron hóa trị. Câu 14. Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào sau đây? A. Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn. B. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử. C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng. D. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thàng một cột. Câu 15. Điện tích hạt nhân của nguyên tử Clo có 17 electron là? A. 17+ B. 18+ C. 19+ D. 20+ Câu 16. Phát biểu nào sau đây không đúng? 6 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 A. Trong chu kì 2 và 3, số electron lớp ngoài cùng tăng từ 1 đến 8. B. Chu kì mở đầu là một kim loại điển hình và kết thúc là một phi kim điển hình. C. Trong chu kỳ, các nguyên tố được sắp xếp theo chiều tăng dần điện tích hạt nhân. D. Trong cùng một chu kì, các nguyên tử có số lớp electron bằng nhau. Câu 17. Trong một nhóm A, bán kính nguyên tử các nguyên tố: A. Tăng theo chiều tăng của điện tích hạt nhân.B. Tăng theo chiều tăng của độ âm điện. C. giảm theo chiều tăng của điện tích hạt nhân. D. giảm theo chiều tăng của tính kim loại. Câu 18. Nguyên tử 27 Al có : 13 A. 13p, 13e, 14n. B. 13p, 14e, 14n. C. 13p, 14e, 13n. D. 14p, 14e, 13n. Câu 19. Cấu hình electron nào sau đây của nguyên tố kim loại? A. 1s22s22p63s23p6.B. 1s 22s22p63s23p5. C. 1s22s22p63s23p3.D. 1s 22s22p63s23p1. Câu 20. Một nguyên tử có 14 electron. Số electron trên phân lớp p của nguyên tử này là: A. 2. B. 4. C. 6. D. 8. Câu 21. Trong các hydoxide của các nguyên tố chu kì 3, hydroxide có tính axit mạnh nhất là A. H2SO4. B. HClO4. C. H2SiO3. D. H3PO4. 23 Câu 22. Tính số e và p trong ion 11 Na +: A. 11 e, 11 p.B. 10 e, 11 p.C. 11 e, 12 p.D. 10 e, 10 p. Câu 23. Cho các nguyên tố sau: Si (Z = 14), P (Z = 15) và S (Z = 16). Các giá trị độ âm điện tương ứng trong trường hợp nào sau đây là đúng? A. Si (2,19); P (1,90); S (2,58). B. Si (2,58); P (2,19); S (1,90). C. Si (1,90); P (2,19); S (2,58). D. Si (1,90); P (2,58); S (2,19). Câu 24. Các nguyên tố nhóm B trong bảng tuần hoàn là? A. các nguyên tố s và các nguyên tố p.B. các nguyên tố p và các nguyên tố d. C. các nguyên tố d và các nguyên tố f.D. các nguyên tố s và các nguyên tố f. Câu 25. Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là? A. chu kì 3, nhóm VIIIAB. chu kì 4, nhóm IIA C. chu kì 3, nhóm VIIA D. chu kì 4, nhóm IA Câu 26. Độ âm điện của một nguyên tử đặc trưng cho A. khả năng hút electron liên kết của một nguyên tử trong phân tử. B. khả năng nhường electron của nguyên tử đó cho nguyên tử khác. C. khả năng tham gia phản ứng mạnh hay yếu của nguyên tử đó. D. khả năng nhường proton của nguyên tử đó cho nguyên tử khác. Câu 27. Các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần như sau: A. I, Br, Cl, F. B. F, Cl, Br, I. C. I, Br, F, Cl. D. Br, I, Cl, F. Câu 28. Độ âm điện của các nguyên tố F, Cl, Br và I xếp theo chiều giảm dần là A. Cl > F > I > Br. B. I > Br > Cl > F. C. F > Cl > Br > I. D. I > Br > F > Cl. Câu 29: X là nguyên tố nhóm IIIA. Công thức oxide ứng với hóa trị cao nhất của X là 7 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 A. XO. B. XO2. C. X2O. D. X2O3. Câu 30: Cho các oxide sau: Na2O, Al2O3, MgO, SiO2. Thứ tự giảm dần tính base là A. Na2O > Al2O3 > MgO > SiO2. B. Al2O3 > SiO2 > MgO > Na2O. C. Na2O > MgO > Al2O3 > SiO2. D. MgO > Na2O > Al2O3 > SiO2. Câu 31. So sánh tính kim loại của Na, Mg, Al A. Mg>Al>Na.B. Mg>Na>Al C. Al>Mg>NaD. Na>Mg>Al. Câu 32. Biểu thức nào sau đây không đúng? .Trong nguyên tử: A. A = Z + N . B. E = Z. C. E = A - N. D. N = Z + E Câu 33. Nguyên tử của nguyên tố nào sau đây có độ âm điện nhỏ nhất? A. Cl.B. I.C. Br.D. F. 1H, 2 H, 3 H 35Cl, 37Cl Câu 34. Số loại phân tử HCl được hình thành từ 3 đồng vị 1 1 1 và 2 đồng vị 17 17 là A. 3. B. 4. C. 5. D. 6. Câu 35. Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là A. 1s22s22p6. B. 1s22s22p63s23p1. C. 1s22s22p63s3. D. 1s22s22p63s2. Câu 36. Dãy gồm nguyên tử X và các ion Y2+, Z- đều có cấu hình electron phân lớp ngoài cùng 3p6 là A. Ne, Mg2+, F-.B. Ne, Ca 2+, Cl-. C. Ar, Fe2+, Cl-.D. Ar, Ca 2+, Cl-. Câu 37. Nguyên tố X ở ô thứ 17 của bảng tuần hoàn. Có các phát biểu sau: (1) X có độ âm điện lớn và là một phi kim mạnh. (2) X có thể tạo thành ion bền có dạng X+. (3) Oxide cao nhất của X có công thức X2O5 và là acidic oxide. (4) Hydroxide của X có công thức HXO4 và là acid mạnh. Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4. Câu 38. Dãy gồm các chất có tính base tăng dần là: A. Al(OH)3, Mg(OH)2, NaOH. B. NaOH, Mg(OH)2, Al(OH)3. C. Mg(OH)2, Al(OH)3, NaOH. D. Al(OH)3, NaOH, Mg(OH)2. Câu 39. Oxit cao nhất của R có dạng R 2O5. Trong hợp chất khí của R với hiđro thì R chiếm 91,18 % về khối lượng. Nguyên tố R là A. C. P B. N. D. Sb. Câu 40. Cấu hình electron của nguyên tử 39X là 1s22s22p63s23p64s1. Nguyên tử 39X có đặc điểm: (a) Nguyên tố thuộc chu kì 4, nhóm IA. (b) Số nơtron trong hạt nhân nguyên tử X là 20. (c) X là nguyên tố kim loại mạnh. (d) X có thể tạo thành ion X+ có cấu hình electron là 1s22s22p63s23p6. (e) X là nguyên tố mở đầu của chu kì 4. Số phát biểu đúng là A. 2. B. 3. C. 4. D. 5. Câu 41. Tính chất hoặc đại lượng vật lí nào sau đây, biến thiên tuần hoàn theo chiều tăng dần của điện tích hạt nhân nguyên tử? (1) bán kính nguyên tử; (2) tổng số e; (3) tính kim loại; (4) tính phi kim; (5) độ âm điện; (6) Nguyên tử khối 8 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 A. (1), (2), (3).B. (3), (4), (6). C. (2), (3,) (4).D. (1),(3),(4),(5). Câu 42: Liên kết hóa học là A. Sự kết hợp các nguyên tử tạo thành phân tử hay tinh thể bền vững. B. Sự kết hợp các chất tạo thành vật thể bền vững. C. Sự kết hợp các phân tử hình thành các chất bền vững. D. Sự kết hợp các hạt cơ bản hình thành nguyên tử bền vững. Câu 43: Khuynh hướng nào dưới đây không xảy ra trong quá trình hình thành liên kết hóa học: A. Chia tách electron. B. Cho nhận electron. C. Góp chung electron. D. Dùng chung electron tự do. Câu 44: Theo quy tắc octet thì nguyên tử có xu hướng đạt cấu trúc bền giống như: A. Kim loại kiềm gần kề. B. Kim loại kiềm thổ gần kề. C. Nguyên tử halogen gần kề. D. Nguyên tử khí hiếm gần kề. Câu 45: Trong nguyên tử, electron hóa trị là các electron A. Độc thân. B. Ở phân lớp ngoài cùng. C. Ở obitan ngoài cùng. D. Tham gia tạo liên kết hóa học. Câu 46: Phân tử nào dưới đây “không tuân theo” quy tắc octet? A. PCl5.B. CH 4. C. H2S. D. NH3. Câu 47: Vì sao các nguyên tử (không xét các nguyên tử khí hiếm) lại thường có xu hướng liên kết với nhau thành phân tử? A. Để mỗi nguyên tử trong phân tử đạt được cơ cấu electron ổn định, bền vững. B. Để mỗi nguyên tử trong phân tử đều đạt được được cấu hình bền vững ở lớp ngoài cùng. C. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8. D. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất. Câu 48: Nguyên tử của nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khí hiếm neon khi tham gia hình thành liên kết hoá học? A. Sulfur (Z = 16). B. Oxygen (Z = 8). C. Hydrogen (Z = 1). D. Chlorine (Z = 17). Câu 50: Trong các hợp chất, để đạt được cấu hình bền của khí hiếm gần nhất mỗi nguyên tử magnesium đã: A. Nhường đi 2 e. B. Nhận vào 1 e. C. Nhường đi 3 e. D. Nhận vào 2 e. Câu 52: Khi tham gia hình thành liên kết hóa học, các nguyên tử lithium (Z = 3) và chlorine (Z = 17) có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây? A. Helium và argon. B. Helium và neon. C. Argon và helium. D. Neon và argon. Câu 53: Để đạt được cấu hình bền vững, nguyên tử bromine thường nhận thêm một electron. Phương trình nào dưới đây biểu diễn đúng quá trình trên? A. Br → Br - + e -. B. Br → Br + + e –. C. Br + + e - → Br. D. Br + e - → Br -. Câu 54: Bản chất của liên kết ion là A. Sự dùng chung các electron. B. Lực hút tĩnh điện giữa các ion mang điện tích trái dấu. C. Lực hút tĩnh điện giữa cation kim loại với các electron tự do. D. Lực hút giữa các phân tử. Câu 55: Hoàn thành nội dung sau: “Các thường tan nhiều trong nước. Khi nóng chảy và khi hoà tan trong nước, chúng dẫn điện, còn ở trạng thái rắn thì không dẫn điện”. 9 ÔN TÂP HỌC KỲ I LÊ PHẠM HUYỀN MY 0365340190 A. Hợp chất vô cơ.B. Hợp chất hữu cơ. C. hợp chất ion.D. hợp chất cộng hoá trị. Câu 56: Liên kết ion được tạo thành giữa hai nguyên tử A. Kim loại điển hình. B. Phi kim điển hình. C. Kim loại và phi kim. D. Kim loại điển hình và phi kim điển hình. Câu 57: Có 2 nguyên tố X (Z = 19); Y (X = 17) hợp chất tạo bởi X và Y có công thức và kiểu liên kết là A. XY, liên kết ion. B. X2Y, liên kết ion. C. XY, liên kết cộng hóa trị có cực. D. XY2, liên kết cộng hóa trị có cực. Câu 58: Nguyên tử oxygen có cấu hình electron là: 1s22s22p4. Sau khi tạo liên kết, cấu hình ion oxide là A. 1s22s22p2.B. 1s 22s22p43s2.C. 1s 22s22p6. D. 1s22s22p63s2. Câu 59: Dãy chất nào sau đây phân tử có chứa liên kết ion? A. NaCl, H2O, KCl, CsF.B. KF, NaCl, NH 3, HCl. C. NaCl, KCl, KF, CsF. D. CH 4, SO2, NaCl, KF. Câu 60: Liên kết cộng hóa trị là liên kết A. Giữa các phi kim với nhau. B. Trong đó cặp electron chung bị lệch về một nguyên tử. C. Được hình thành do sự dùng chung electron của 2 nguyên tử khác nhau. D. Được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung. Câu 61: Cặp nguyên tử nào dưới đây liên kết với nhau tạo hợp chất cộng hoá trị? A. H và He. B. Na và F. C. Li và F. D. H và Cl. Câu 62: Hợp chất có liên kết cộng hoá trị được gọi là A. Hợp chất phức tạp. B. Hợp chất cộng hóa trị. C. Hợp chất không điện li D. Hợp chất trung hoà điện. Câu 63: Tuỳ thuộc vào số cặp electron dùng chung tham gia tạo thành liên kết cộng hóa trị giữa 2 nguyên tử mà liên kết được gọi là A. Liên kết phân cực, liên kết lưỡng cực, liên kết ba cực. B. Liên kết đơn giản, liên kết phức tạp. C. Liên kết đơn, liên kết đôi, liên kết ba. D. Liên kết xich ma, liên kết pi, liên kết delta. Câu 64: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết A. Cộng hoá trị không cực. B. Hydrogen. C. Cộng hoá trị có cực. D. Ion. Câu 65: Liên kết hoá học giữa các nguyên tử trong phân tử H 2O là liên kết A. Cộng hoá trị không phân cực. B. Hydrogen. C. Cộng hoá trị có cực. D. Ion. Câu 66: Trong phân tử nào chỉ tồn tại liên kết đơn? A. N2 B. O2 C. F2 D. CO2. Câu 67: Cho độ âm điện của H = 2,2, Na = 0,93, C = 2,55 và O = 3,44. Liên kết nào dưới đây là liên kết cộng hóa trị không phân cực? A. Na-O. B. O-H. C. Na-C. D. C-H. ..............Chúc các em thi tốt............... 10
File đính kèm:
 de_cuong_tu_luyen_on_tap_cuoi_hoc_ki_1_hoa_hoc_10_nam_hoc_20.docx
de_cuong_tu_luyen_on_tap_cuoi_hoc_ki_1_hoa_hoc_10_nam_hoc_20.docx

