Đề kiểm tra cuối học kì II Hóa học 10 - Mã đề 222 - Năm học 2022-2023 - Trường THPT Nguyễn Văn Thoại (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra cuối học kì II Hóa học 10 - Mã đề 222 - Năm học 2022-2023 - Trường THPT Nguyễn Văn Thoại (Có đáp án)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra cuối học kì II Hóa học 10 - Mã đề 222 - Năm học 2022-2023 - Trường THPT Nguyễn Văn Thoại (Có đáp án)
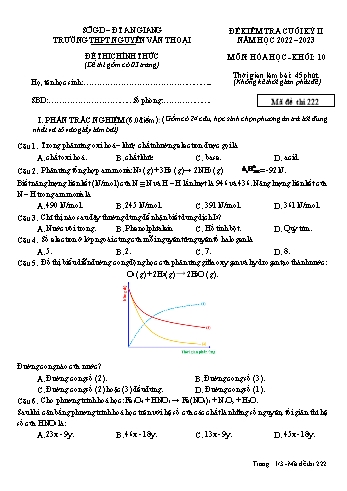
SỞ GD – ĐT AN GIANG ĐỀ KIỂM TRA CUỐI KỲ II TRƯỜNG THPT NGUYỄN VĂN THOẠI NĂM HỌC 2022 – 2023 ĐỀ THI CHÍNH THỨC MÔN: HÓA HỌC - KHỐI: 10 (Đề thi gồm có 03 trang) Thời gian làm bài: 45 phút Họ, tên học sinh: ... (Không kể thời gian phát đề) SBD: Số phòng: . Mã đề thi 222 I. PHẦN TRẮC NGHIỆM (6.0 điểm): (Gồm có 24 câu; học sinh chọn phương án trả lời đúng nhất và tô vào giấy làm bài) Câu 1. Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là A. chất oxi hoá. B. chất khử. C. base. D. acid. 0 Câu 2. Phản ứng tổng hợp ammonia: N2 (g) + 3H2 (g) → 2NH3 (g) rH298 = -92 kJ. Biết năng lượng liên kết (kJ/mol) của N ≡ N và H – H lần lượt là 946 và 436. Năng lượng liên kết của N – H trong ammonia là A. 490 kJ/mol. B. 245 kJ/mol. C. 391 kJ/mol. D. 361 kJ/mol. Câu 3. Chỉ thị nào sau đây thường dùng để nhận biết dung dịch I2? A. Nước vôi trong. B. Phenolphtalein. C. Hồ tinh bột. D. Quỳ tím. Câu 4. Số electron ở lớp ngoài cùng của mỗi nguyên tử nguyên tố halogen là A. 5. B. 2. C. 7. D. 8. Câu 5. Đồ thị biểu diễn đường cong động học của phản ứng giữa oxygen và hydrogen tạo thành nước: O2 (g) + 2H2(g) ⟶ 2H2O (g). Đường cong nào của nước? A. Đường cong số (2). B. Đường cong số (3). C. Đường cong số (2) hoặc (3) đều đúng. D. Đường cong số (1). Câu 6. Cho phương trình hoá học: Fe3O4 + HNO3 → Fe(NO3)3 + NxOy + H2O. Sau khi cân bằng phương trình hoá học trên với hệ số của các chất là những số nguyên, tối giản thì hệ số của HNO3 là: A. 23x - 9y. B. 46x - 18y. C. 13x - 9y. D. 45x - 18y. Trang 1/3 -Mã đề thi 222 Câu 7. Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều A. 0. Câu 8. Hiện tượng nào dưới đây có tốc độ phản ứng nhanh nhất? A. Tấm tôn bị gỉ sét. B. Nướng bánh mì. C. Lên men sữa chua. D. Đốt gas khi nấu ăn. Câu 9. Biết rằng, khi nhiệt độ tăng thêm 10 oC, tốc độ của một phản ứng hóa học tăng 4 lần; tốc độ phản ứng giảm bao nhiêu lần khi nhiệt độ giảm từ 70oC xuống 40oC? A. 16 lần. B. 32 lần. C. 8 lần. D. 64 lần. Câu 10. Dãy nào sau đây sắp xếp các nguyên tố halogen theo chiều tính oxi hóa giảm dần? A. I, Br, Cl, F. B. Br, I, Cl, F. C. F, Br, Cl, I. D. F, Cl, Br, I. Câu 11. Tính chất hoá học đặc trưng của các đơn chất halogen là A. tính base. B. tính khử. C. tính oxi hoá. D. tính acid. Câu 12. Khi đun nấu thức ăn, nếu củi được chẻ nhỏ thì quá trình cháy xảy ra nhanh hơn. Vậy người ta đã dựa vào yếu tố nào sau đây để tăng tốc độ phản ứng? A. Bề mặt tiếp xúc. B. Áp suất. C. Nhiệt độ. D. Nồng độ. Câu 13. “Muối i-ốt" có thành phần chính là sodium chloride (NaCl) có bổ sung một lượng nhỏ potassium iodide (KI) nhằm bổ sung nguyên tố vi lượng iodine cho cơ thể, nhằm ngăn bệnh bứu cổ, phòng ngừa khuyết tật trí tuệ và phát triển,. Trong 100 g muối i-ốt có chứa hàm lượng ion iodide dao động từ 2200 µg – 2500 µg; lượng iodide cần thiết cho một thiếu niên hay người trưởng thành từ 66 µg – 110 µg/ngày. Trung bình, một thiếu niên hay trưởng thành cần bao nhiêu g muối i-ốt trong một ngày? A. 2,46 – 8,80 gam. B. 49 – 77 gam. C. 2,64 – 5,00 gam. D. 6,0 – 9,0 gam. 0 Câu 14. Biểu thức đúng tính rH298 của phản ứng theo giá trị enthalpy tạo thành chuẩn của các chất là: 0 0 0 0 0 0 A. r H298 f H298 (sp) f H298 (c®) . B. r H298 f H298 (c®) f H298 (sp) . 0 0 0 0 0 0 C. r H298 f H298 (sp) f H298 (c®) . D. r H298 f H298 (sp) f H298 (c®) . Câu 15. Dung dịch hydrohalic acid có khả năng ăn mòn thuỷ tinh là A. HF. B. HI. C. HCl. D. HBr. Câu 16. Cho 3,16 gam KMnO4 phản ứng hết với dung dịch HCl đặc (dư), thu được V lít khí Cl2 (đkc). Giá trị của V là (K=39; Mn=55; O=16) A. 6,1975. B. 3,7185. C. 7,4370. D. 1,2395. Câu 17. Số oxi hóa của halogen X trong hợp chất HX là A. -1. B. 0. C. +2. D. +1. Câu 18. Ở điều kiện thường, halogen tồn tại ở thể rắn, có màu đen tím là A. F2. B. Cl2. C. I2. D. Br2. Câu 19. Dung dịch nào sau đây có thể phân biệt hai dung dịch NaF và NaCl? A. Br2. B. HF. C. AgNO3. D. HCl. Trang 2/3 -Mã đề thi 222 Câu 20. Cho các phát biểu sau: (a) Trong phản ứng oxi hóa – khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử. (b) Phản ứng thu nhiệt là phản ứng hóa học trong đó có sự hấp thụ nhiệt năng từ các chất phản ứng. (c) Các phản ứng nhiệt nhôm, phản ứng trung hòa (acid tác dụng với base), các phản ứng trùng hợp, quá trình hô hấp, sự phân hạch hạt nhân đều là các quá trình tỏa nhiệt. (d) Hằng số tốc độ phản ứng k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ. (e) Chất xúc tác làm tăng tốc độ của phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng. (g) Bromine được sử dụng để điều chế thuốc an thần, thuốc trừ sâu, thuốc nhuộm, mực in, (h) Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Số phát biểu đúng là: A. 3. B. 5. C. 2. D. 4. Câu 21. Áp suất đối với chất khí ở điều kiện chuẩn là A. 1 atm. B. 760 mmHg. C. 1 Pa. D. 1 bar. 0 2 Câu 22. Cho quá trình Zn Zn + 2e , đây là quá trình A. khử. B. oxi hóa. C. nhận proton. D. tự oxi hóa – khử. o Câu 23. Phản ứng tỏa nhiệt có rH298 A. không xác định. B. bằng 0. C. > 0. D. < 0. Câu 24. Khi tăng nhiệt độ thì A. tốc độ phản ứng giảm. B. tốc độ phản ứng tăng. C. có thể tăng hoặc giảm tốc độ phản ứng. D. không ảnh hưởng đến tốc độ phản ứng. II. PHẦN TỰ LUẬN (4.0 điểm) Câu 1: (1.0 điểm) Cho phản ứng đơn giản xảy ra trong bình kín: 2NO (g) + O2 (g) 2NO2 (g) a. Viết biểu thức tốc độ trung bình (theo tất cả các chất). b. Viết biểu thức tốc độ tức thời của phản ứng. Câu 2: (1.0 điểm) Viết phương trình hóa học của phản ứng xảy ra trong các trường hợp: a. Dung dịch KOH phản ứng với dung dịch HCl. b. Muối MgCO3 phản ứng với dung dịch HCl. Câu 3: (2.0 điểm) Khi cho 15,5 gam hỗn hợp kim loại copper (Cu) và aluminium (Al) tác dụng với chlorine thì cần vừa đủ 8,6765 lít khí Cl2 ở đkc. a. Viết các phương trình hóa học xảy ra. b. Tính khối lượng từng kim loại có trong hỗn hợp ban đầu. (Cu=64; Al=27) -----------------------Hết----------------------- Trang 3/3 -Mã đề thi 222
File đính kèm:
 de_kiem_tra_cuoi_hoc_ki_ii_hoa_hoc_10_ma_de_222_nam_hoc_2022.docx
de_kiem_tra_cuoi_hoc_ki_ii_hoa_hoc_10_ma_de_222_nam_hoc_2022.docx ĐÁP ÁN - Thai Huu Vi.docx
ĐÁP ÁN - Thai Huu Vi.docx

