Đề kiểm tra giữa học kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Phan Đình Phùng (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề kiểm tra giữa học kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Phan Đình Phùng (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra giữa học kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Phan Đình Phùng (Có đáp án + Ma trận)
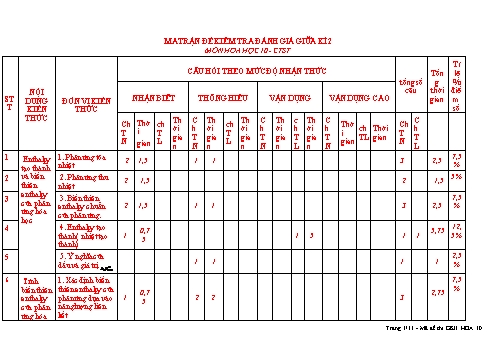
MA TRẬN ĐỀ KIỂM TRA ĐÁNH GIÁ GIỮA KÌ 2 MÔN HÓA HỌC 10 - CTST Tỉ CÂU HỎI THEO MỨC ĐỘ NHẬN THỨC Tổn lệ tổng số g % NỘI câu thời điể ST DUNG ĐƠN VỊ KIẾN NHẬN BIÊT THÔNG HIỂU VẬN DỤNG VẬN DỤNG CAO gian m T KIẾN THỨC số THỨC Th C Th Th C Th c Th C C Ch Thờ ch ch Thờ Ch ời h ời ời h ời h ời h ch Thời h T i T T i T gia T gia gia T gia T gia T TL gian T N L L gian N gian n N n n N n L n N L 1 1. Phản ứng tỏa 7,5 Enthalpy 2 1,5 1 1 3 2,5 tạo thành nhiệt % 2 và biến 2. Phản ứng thu 5% 2 1,5 2 1,5 thiên nhiệt enthalpy 3 3. Biến thiên 7,5 của phản enthalpy chuẩn 2 1,5 1 1 3 2,5 % ứng hóa của phản ứng. học 4 4. Enthalpy tạo 12, 0,7 5,75 thành ( nhiệt tạo 1 1 5 1 1 5% 5 thành) 5 5. Ý nghĩa của 2,5 1 1 1 1 dấu và giá trị 0 % r H298 6 Tính 1. Xác định biến 7,5 thiên enthalpy của % biến thiên 0,7 2,75 phản ứng dựa vào 1 2 2 3 enthalpy 5 của phản năng lượng liên ứng hóa kết Trang 1/11 - Mã đề thi GKII HOA 10 7 học 2. Xác định biến 12, thiên enthalpy của 5% phản ứng dựa vào 3 3 1 5,5 3 1 8,5 enthalpy tạo thành. Phương 7,5 8 Tốc độ phản ứng 2 1,5 1 1 3 2,5 trình tốc % độ phản ứng và Biểu thức tốc độ 12,5 2 1,5 1 1 1 5,5 3 1 8 hằng số phản ứng % tốc độ Các yếu tố ảnh Các yếu hưởng đến tốc độ 2 1,5 1 1 1 5 3 1 7,5 17,5 tố ảnh phản ứng hưởng đến tốc Ý nghĩa thực tiễn cuả tốc độ phản 7,5 độ phản 2 1,5 1 1 3 2,5 ứng ứng trong đời % sống và sản xuất tổng 16 12 12 12 2 10 2 11 28 4 45 2 1 10 tỉ lệ 40 30 70 30 0 0 0 Tổng 10 4 3 2 1 7 3 điểm Trang 2/11 - Mã đề thi GKII HOA 10 TRƯỜNG THPT PHAN ĐÌNH PHÙNG ĐỀ KIỂM TRA GIỮA KÌ HỌC KỲ II NĂM HỌC 2022 - 2023 TỔ TỰ NHIÊN HÓA HỌC 10 - ĐỀ CHÍNH THỨC Thời gian làm bài: 45 phút; Mã đề thi: ĐỀ CHUẨN (28 câu trắc nghiệm, 4 câu tự luận) Họ, tên thí sinh:.............................................................Lớp: .SBD: ............................. Câu 1: Phản ứng tỏa nhiệt là phản ứng trong đó A. hỗn hợp phản ứng truyền nhiệt cho môi trường. B. chất phản ứng truyền nhiệt cho sản phẩm. C. chất phản ứng thu nhiệt từ môi trường D. các chất sản phẩm thu nhiệt từ môi trường. o Câu 2: Quy ước về dấu của nhiệt phản ứng ( rH298 ) nào sau đây là đúng? o o A. Phản ứng tỏa nhiệt có rH298 > 0. B. Phản ứng thu nhiệt có rH298 < 0. o o C. Phản ứng tỏa nhiệt có rH298 < 0. D. Phản ứng thu nhiệt có rH298 = 0. Câu 3: Nung nóng hai ống nghiệm chứa NaHCO3 và P, xảy ra các phản ứng sau: 2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O(g) (1) 4P(s) + 5O2(g) 2P2O5(s) (2) Khi ngừng đun nóng, phản ứng (1) dừng lại còn phản ứng (2) tiếp tục xảy ra, chứng tỏ A. phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt. B. phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt. C. cả 2 phản ứng đều toả nhiệt. D. cả 2 phản ứng đều thu nhiệt. Câu 4: Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường? A. Phản ứng nhiệt phân Cu(OH)2. B. Phản ứng giữa H2 và O2 trong hỗn hợp khí. C. Phản ứng giữa Zn và dung dịch H2SO4. D. Phản ứng đốt cháy cồn. Trang 3/11 - Mã đề thi GKII HOA 10 0 Câu 5: Nung KNO3 lên 550 C xảy ra phản ứng: 1 o KNO3(s) KNO2(s) + O (g) H ? 2 2 r 298 Phản ứng nhiệt phân KNO3 là phản ứng o o A. toả nhiệt, có rH298 0. o o C. toả nhiệt, có rH298 > 0. D. thu nhiệt, có rH298 < 0. Câu 6: Cho 2 phương trình nhiệt hóa học sau: o C (s) + H2O (g) CO (g) + H2 (g) rH 298 = +121,25 kJ (1) o CuSO4 (aq) + Zn (s) ZnSO4 (aq) + Cu(s) rH 298 = -230,04 kJ (2) Chọn phát biểu đúng. A. Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng 2 là phản ứng thu nhiệt. B. Phản ứng (1) là phản ứng thu nhiệt, phản ứng 2 là phản ứng tỏa nhiệt . C. Phản ứng (1) và (2) là phản ứng thu nhiệt. D. Phản ứng (1) và (2) là phản ứng tỏa nhiệt. Câu 7: Cho phương trình nhiệt hóa học của phản ứng: o N2(g) + O2(g) 2NO(l) = +179,20kJ rH298 Phản ứng trên là phản ứng A. thu nhiệt. B. không có sự thay đổi năng lượng. C. tỏa nhiệt. D. có sự giải phóng nhiệt lượng ra môi trường. Câu 8: Cho các phát biểu: (a) Tất cả các phản ứng cháy đều tỏa nhiệt. (b) Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt. (c) Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều tỏa nhiệt. (d) Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng. Số phát biểu đúng là Trang 4/11 - Mã đề thi GKII HOA 10 A. 1. B. 2. C. 3. D. 4. Câu 9: Cho các chất sau, chất nào có enthalpy tạo thành chuẩn bằng 0 ? A. CaCO3(s). B. SO2(g). C. Cl2(g). D. CH4(g) Câu 10: Nhiệt tạo thành chuẩn của một chất là nhiệt lượng tạo thành 1 mol chất đó từ chất nào ở điều kiện chuẩn? A. những hợp chất bền vững nhất. B. những đơn chất bền vững nhất. C. những oxide có hóa trị cao nhất. D. những dạng tồn tại bền nhất trong tự nhiên. Câu 11: Cho các phát biểu: (a) Biến thiên enthalpy chuẩn của một phản ứng hóa học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25o C. (b) Nhiệt (tỏa ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó. (c) Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt. (d) Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường. Số phát biểu đúng là A. 2. B. 3. C. 4. D. 1. Câu 12: Cho các giá trị năng lượng liên kết của một số liên kết: Liên kết H – H O – O O = O H - O Eb(kJ/mol) 436 142 498 460 Biến thiên enthalpy chuẩn của phản ứng: H2(g) + O2(g) → H2O2(g) là A. -128 kJ. B. - 333 kJ. C. - 841 kJ. D. -381 kJ. Câu 13: Enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) đối với chất khí được xác định trong điều kiện áp suất là A. 1 Pa. B. 1 atm. C. 760 mmHg. D. 1 bar. Câu 14: Một phản ứng hóa học được biểu diễn như sau: Các chất phản ứng → Các sản phẩm. Yếu tố nào sau đây không ảnh hướng đến tốc độ phản ứng? A. Chất xúc tác B. Nồng độ các chất phản ứng C. Nồng độ các sản phẩm D. Nhiệt độ Trang 5/11 - Mã đề thi GKII HOA 10 Câu 15: Có một số hiện tượng sau: (1) nướng bánh mì, (2) đốt khí ga khi nấu ăn, (3) cửa sắt bị han gỉ, (4) đốt củi luộc bánh chưng. Hiện tượng có tốc độ phản ứng chậm nhất là: A. (1). B. (2). C. (3). D. (4). Câu 16: Sử dụng tủ lạnh để giữ cho thực phẩm được tươi lâu là chúng ta đã vận dụng yếu tố nào để làm thay đổi tốc độ của phản ứng? A. Nồng độ. B. Áp suất. C. Bề mặt tiếp xúc. D. Nhiệt độ Câu 17: Chọn hình ảnh phù hợp minh họa cho hiện tượng có sử dụng yếu tố tăng diện tích bề mặt tiếp xúc để tăng tốc độ phản ứng. A. B. C. D. Câu 18: Cho phản ứng xảy ra trong pha khí sau: H2 + Cl2 2HCl. Biểu thức tốc độ trung bình của phản ứng là: C C C C C C A. v H2 Cl2 HCl . B. v H2 Cl2 HCl . t t t t t t C C C C C C C. v H2 Cl2 HCl . D. v H2 Cl2 HCl . t t t t t 2 t Câu 19: Cho các giá trị ∆f của tất cả các chất đầu và sản phẩm thì công thức tính đúng là A. ∆r = B. ∆r = C. ∆r = D. ∆r = Câu 20: Cho Fe (hạt) phản ứng với dung dịch HCl 1M. Thay đổi các yếu tố sau: (1) Thêm vào hệ một lượng nhỏ dung dịch CuSO4. (2) Thêm dung dịch HCl 1M lên thể tích gấp đôi. (3) Nghiền nhỏ hạt sắt thành bột sắt. (4) Pha loãng dung dịch HCl bằng nước cất lên thể tích gấp đôi. Có bao nhiêu cách thay đổi tốc độ phản ứng? A. 1. B. 4. C. 3. D. 2. Câu 21: Đối với phản ứng có chất khí tham gia thì nhận định nào dưới đây đúng? A. Khi áp suất tăng thì tốc độ phản ứng giảm. B. Khi áp suất tăng thì tốc độ phản ứng tăng. Trang 6/11 - Mã đề thi GKII HOA 10 C. Khi áp suất giảm thì tốc độ phản ứng tăng. D. Áp suất không ảnh hưởng đến tốc độ phản ứng. Câu 22: Khi ninh (hầm) thịt cá, người ta sử dụng những cách sau. (1) Dùng nồi áp suất (3) Chặt nhỏ thịt cá. (2) Cho thêm muối vào. (4) Nấu cùng nước lạnh. Cách làm cho thịt cá nhanh chín hơn là: A. 1, 2, 3. B. 1, 3, 4. C. 2, 3, 4. D. 1, 2, 4. Câu 23: Thực hiện phản ứng: 2H2O2 (l) → 2H2O (l) + O2 (g) Cho các yếu tố: (1) tăng nồng độ H2O2, (2) giảm nhiệt độ, (3) thêm xúc tác MnO2. Những yếu tố làm tăng tốc độ phản ứng là A. 1, 3. B. chỉ 3. C. 1, 2. D. 1, 2, 3. Câu 24: Cho một mẩu đá vôi nặng 10 gam vào 200 ml dung dịch HCl 2 M. Tốc độ phản ứng ban đầu sẽ giảm khi A. nghiền nhỏ đá vôi trước khi cho vào. B. thêm 100 ml dung dịch HCl 4 M. C. giảm nhiệt độ của phản ứng. D. cho thêm 500 ml dung dịch HCl 1 M vào hệ ban đầu. Câu 25: Cho phản ứng hóa học sau: Zn(s) + H2SO4 (aq) ZnSO4 (aq) + H2 (g) Yếu tố nào sau đây không ảnh hưởng đến tốc độ phản ứng? A. Diện tích bề mặt zinc. B. Nồng độ dung dịch sulfuric acid. C. Thể tích dung dịch sulfuric acid. D. Nhiêt độ của dung dịch sulfuric acid. Câu 26: Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây? A. Dạng viên nhỏ. B. Dạng bột mịn, khuấy đều. C. Dạng tấm mỏng. D. Dạng nhôm dây. Câu 27: Phương trình hóa học của phản ứng: CHCl3(g) + Cl2(g) CCl4(g) + HCl(g). Khi nồng độ của CHCl3 giảm 4 lần, nồng độ Cl2 giữ nguyên thì tốc độ phản ứng sẽ A. Tăng gấp đôi.B. Giảm một nửa.C. Tăng 4 lần.D. Giảm 4 lần. Câu 28: Cho bột Fe vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu sau đây không đúng? A. Khí H2 thoát ra nhanh hơn. B. Bột Fe tan nhanh hơn. C. Lượng muối thu được nhiều hơn so với không đun nóng khi phản ứng kết thúc. Trang 7/11 - Mã đề thi GKII HOA 10 D. Nồng độ HCl giảm nhanh hơn. ----------------------------------------------- B. TỰ LUẬN: 3 điểm – 4 câu o Câu 29: (1 điểm) Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 45 C: N2O5 → N2O4 + O2 Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tính tốc độ trung bình của phản ứng tính theo N2O5? Câu 30: (1 điểm) Phản ứng tổng hợp ammonia: o N2(g) + 3H2(g) 2NH3(g) Δ r H 298 = -92 kJ Biết năng lượng liên kết (kJ/mol) của N N và H – H lần lượt là 946 và 436. Hãy tính năng lượng liên kết của N H trong ammonia ? Câu 31: ( 0,5 điểm) Cho các phản ứng sau xảy ra ở điều kiện chuẩn: CH4(g) + 2O2(g) →CO2(g) + 2H2O(l) = -890,36 kJ CaCO3(s) →CaO(s) + CO2(s) )= 178,29 kJ Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn bao nhiêu gam CH4(g) để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%. Câu 32 ( 0,5 điểm) Ở 200C, tốc độ một phản ứng là 0,05 mol/(L.min). Ở 300C, tốc độ phản ứng này là 0,15 mol/(L.min). (a) Hãy tính hệ số nhiệt độ Van’t Hoff của phản ứng trên. (b) Dự đoán tốc độ phản ứng trên ở 400C (giả thiết hệ số nhiệt độ trong khoảng nhiệt độ này không đổi). --------HẾT------- Trang 8/11 - Mã đề thi GKII HOA 10 TRƯỜNG THPT PHAN ĐÌNH PHÙNG HƯỚNG DẪN CHẤM TỔ TỰ NHIÊN ĐỀ ĐÁNH GIÁ GIỮA HỌC KÌ 2 MÔN HÓA HỌC 10- CTST A. TRẮC NGHIỆM: 7 điểm – mỗi câu 0,25 điểm CÂU ĐÁP ÁN CÂU ĐÁP ÁN CÂU ĐÁP ÁN CÂU ĐÁP ÁN 1 A 8 B 15 C 22 A 2 C 9 C 16 D 23 A 3 B 10 B 17 D 24 C 4 C 11 A 18 D 25 C 5 B 12 A 19 B 26 B 6 B 13 A 20 C 27 C 7 A 14 C 21 B 28 C B. TỰ LUẬN: 3 điểm - Chú ý: HS giải bằng pp khác nhưng đúng vẫn được điểm tối đa CÂU ĐÁP ÁN BIỂU ĐIỂM Câu 29 2,33 2,08 0,5 v 1,36.10 3 mol / (l.s) 1 điểm 184 0,5 Trang 9/11 - Mã đề thi GKII HOA 10 Câu 30 0,5 1 điểm 0,5 Câu 31 -CH4(g) + 2O2(g) →CO2(g) + 2H2O(l) = - 0,5 điểm 890,36 kJ). →Ở điều kiện chuẩn, khi đốt cháy hoàn toàn 1 mol 0,125 CH4, sản phẩm là CO2(g) và H2O(l) thì sẽ giải phóng một nhiệt lượng là 890,36 kJ. -CaCO3(s) CaO(s) + CO2(s) = 178,29 kJ →Để thu được 1 mol CaO(s), cần phải cung cấp nhiệt 0,125 lượng là 178,29 kJ để chuyển 1 mol CaCO3(s) thành CaO (s). Vậy: Ở điều kiện chuẩn, để cung cấp nhiệt cho phản ứng tạo 2 mol CaO bằng cách nung CaCO3 cần phải đốt cháy: 2×178,29/890,36 ≈ 0,4(mol) CH4. 0,125 →mCH4= 0,4×16 = 6,4 (gam) 0,125 Câu 32 (a) Hệ số nhiệt độ của phản ứng: 0,25 v v 0,15 0,5 điểm T 10 30 3 vT v20 0,05 v v x T 10 40 3 x 0,45 v v 0,05 (b) T 30 mol/(L.min) 0,25 Trang 10/11 - Mã đề thi GKII HOA 10 Trang 11/11 - Mã đề thi GKII HOA 10
File đính kèm:
 de_kiem_tra_giua_hoc_ki_ii_hoa_hoc_10_nam_hoc_2022_2023_truo.doc
de_kiem_tra_giua_hoc_ki_ii_hoa_hoc_10_nam_hoc_2022_2023_truo.doc

