Đề kiểm tra giữa kì 2 Hóa học 10 - Năm học 2022-2023 - Vũ Hồng Quân
Bạn đang xem tài liệu "Đề kiểm tra giữa kì 2 Hóa học 10 - Năm học 2022-2023 - Vũ Hồng Quân", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra giữa kì 2 Hóa học 10 - Năm học 2022-2023 - Vũ Hồng Quân
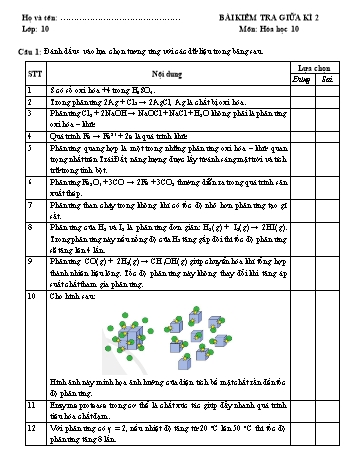
Họ và tên: BÀI KIỂM TRA GIỮA KÌ 2 Lớp: 10 Môn: Hóa học 10 Câu 1: Đánh dấu x vào lựa chọn tương ứng với các dữ liệu trong bảng sau. Lựa chọn STT Nội dung Đúng Sai 1 S có số oxi hóa +4 trong H2SO4. 2 Trong phản ứng 2Ag + Cl2 → 2AgCl, Ag là chất bị oxi hóa. 3 Phản ứng Cl2 + 2NaOH → NaOCl + NaCl + H2O không phải là phản ứng oxi hóa – khử. 4 Quá trình Fe → Fe2+ + 2e là quá trình khử. 5 Phản ứng quang hợp là một trong những phản ứng oxi hóa – khử quan trọng nhất trên Trái Đất, năng lượng được lấy từ ánh sáng mặt trời và tích trữ trong tinh bột. 6 Phản ứng Fe2O3 + 3CO → 2Fe + 3CO2 thường diễn ra trong quá trình sản xuất thép. 7 Phản ứng than cháy trong không khí có tốc độ nhỏ hơn phản ứng tạo gỉ sắt. 8 Phản ứng của H 2 và I2 là phản ứng đơn giản: H 2(g) + I2(g) → 2HI(g). Trong phản ứng này nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng sẽ tăng lên 4 lần. 9 Phản ứng CO(g) + 2H2(g) → CH3OH(g) giúp chuyển hóa khí tổng hợp thành nhiên liệu lỏng. Tốc độ phản ứng này không thay đổi khi tăng áp suất chất tham gia phản ứng. 10 Cho hình sau: Hình ảnh này minh họa ảnh hưởng của diện tích bề mặt chất rắn đến tốc độ phản ứng. 11 Enzyme protease trong cơ thể là chất xúc tác giúp đẩy nhanh quá trình tiêu hóa chất đạm. 12 Với phản ứng có γ = 2, nếu nhiệt độ tăng từ 20 oC lên 50 oC thì tốc độ phản ứng tăng 8 lần. Câu 2 1) Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron. a) NaBr + Cl2 → NaCl + Br2 + − 2+ b) H + MnO4 + HCOOH → Mn + H2O + CO2 2) Cho phản ứng: 2A + B → 2M + 3N. a) Hãy viết biểu thức tốc độ trung bình của phản ứng trên theo sự thay đổi nồng độ chất A và N. b) Nếu biến thiên nồng độ trung bình của chất N là 1,0 mol L -1 s-1 thì tốc độ trung bình của phản ứng và biến thiên nồng độ trung bình của chất A là bao nhiêu ? Họ và tên: BÀI KIỂM TRA GIỮA KÌ 2 Lớp: 10 Môn: Hóa học 10 Câu 1: Đánh dấu x vào lựa chọn tương ứng với các dữ liệu trong bảng sau. Lựa chọn STT Nội dung Đúng Sai 1 S có số oxi hóa +6 trong H2SO4. 2 Trong phản ứng Mg + Cl2 → MgCl2, Mg là chất bị oxi hóa. 3 Phản ứng 2Cl2 + 2Ca(OH)2 → Ca(OCl)2 + CaCl2 + 2H2O không phải là phản ứng oxi hóa – khử. 4 Quá trình Fe2+ +2e → Fe là quá trình khử. 5 Các hoạt động của cơ thể đều cần năng lượng, sự hô hấp đã cung cấp oxygen để oxi hóa các chất như đường glucose, sinh ra năng lượng. 6 Phản ứng Fe3O4 + CO → 3FeO + CO2 thường diễn ra trong quá trình sản xuất gang. 7 Phản ứng nổ của khí bình gas có tốc độ nhỏ hơn phản ứng tạo gỉ sắt. 8 Phản ứng của H 2 và I2 là phản ứng đơn giản: H 2(g) + I2(g) → 2HI(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng viết dưới dạng: v = kC C . H2 I2 9 Thực hiện phản ứng CO(g) + 2H2(g) → CH3OH(g) là một trong những giải pháp quan trọng bổ sung nguồn nhiên liệu sạch. Tốc độ phản ứng này giảm khi tăng áp suất chất tham gia phản ứng. 10 Cho hình sau: Hình ảnh này minh họa ảnh hưởng của diện tích bề mặt chất rắn đến tốc độ phản ứng. 11 Enzyme lipase trong cơ thể là chất xúc tác giúp đẩy nhanh quá trình tiêu hóa chất béo. 12 Với phản ứng có γ = 3, nếu nhiệt độ tăng từ 20 oC lên 50 oC thì tốc độ phản ứng tăng 27 lần. Câu 2 1) Cân bằng các phản ứng oxi hóa – khử sau đây bằng phương pháp thăng bằng electron. a) NaI + Br2 → NaBr + I2 − 2− − b) Cr(OH)3 + OH + Br2 → CrO4 + H2O + + Br 2) Cho phản ứng: 2A + B → 2M + 3N. a) Hãy viết biểu thức tốc độ trung bình của phản ứng trên theo sự thay đổi nồng độ chất B và M. b) Nếu biến thiên nồng độ trung bình của chất M là 1,0 mol L -1 s-1 thì tốc độ trung bình của phản ứng và biến thiên nồng độ trung bình của chất B là bao nhiêu ?
File đính kèm:
 de_kiem_tra_giua_ki_2_hoa_hoc_10_nam_hoc_2022_2023_vu_hong_q.docx
de_kiem_tra_giua_ki_2_hoa_hoc_10_nam_hoc_2022_2023_vu_hong_q.docx

