Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 001+002 - Năm học 2022-2023 - Huyền Phạm (Có đáp án + Ma trận)
Bạn đang xem 20 trang mẫu của tài liệu "Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 001+002 - Năm học 2022-2023 - Huyền Phạm (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 001+002 - Năm học 2022-2023 - Huyền Phạm (Có đáp án + Ma trận)
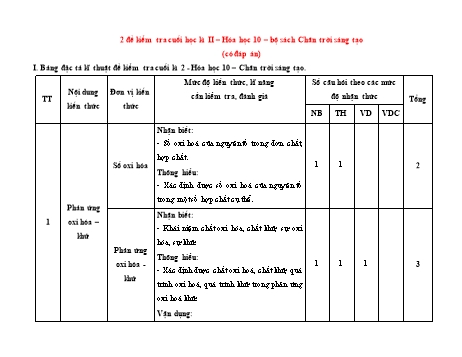
2 đề kiểm tra cuối học kì II – Hóa học 10 – bộ sách Chân trời sáng tạo (có đáp án) I. Bảng đặc tả kĩ thuật đề kiểm tra cuối kì 2 - Hóa học 10 – Chân trời sáng tạo. Mức độ kiến thức, kĩ năng Số câu hỏi theo các mức Nội dung Đơn vị kiến TT cần kiểm tra, đánh giá độ nhận thức Tổng kiến thức thức NB TH VD VDC Nhận biết: - Số oxi hoá của nguyên tố trong đơn chất, hợp chất. Số oxi hóa 1 1 2 Thông hiểu: - Xác định được số oxi hoá của nguyên tố trong một số hợp chất cụ thể. Phản ứng Nhận biết: 1 oxi hóa – - Khái niệm chất oxi hóa, chất khử, sự oxi khử hóa, sự khử. Phản ứng Thông hiểu: oxi hóa - 1 1 1 3 - Xác định được chất oxi hoá, chất khử, quá khử trình oxi hoá, quá trình khử trong phản ứng oxi hoá khử. Vận dụng: - Lập được phương trình hoá học của một số phản ứng oxi hóa - khử. Enthalpy Nhận biết: tạo thành - Dự đoán các phản ứng hoá học là phản ứng và biến toả nhiệt hay thu nhiệt. thiên - Trình bày được khái niệm phản ứng toả 2 2 1 3 enthalpy nhiệt, thu nhiệt; điều kiện chuẩn. của phản Thông hiểu: ứng hoá - Đếm số phát biểu đúng sai liên quan đến Năng học biến thiên enthalpy. lượng hoá Nhận biết: học Ý nghĩa và - Nêu được ý nghĩa của dấu và giá trị 0 cách tính rH298 biến thiên - Dựa vào nhiệt phản ứng xác định phản ứng 2 1 3 enthalpy là toả nhiệt hay thu nhiệt. phản ứng Thông hiểu: hoá học - Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy. Tốc độ Phương Nhận biết: phản ứng trình tốc - Trình bày được khái niệm tốc độ phản hoá học độ phản ứng hoá học và cách tính tốc độ trung bình ứng và của phản ứng. hằng số tốc - Viết được biểu thức tốc độ phản ứng theo 2 2 độ phản hằng số tốc độ phản ứng và nồng độ. ứng Thông hiểu: - Tính được tốc độ trung bình của một phản ứng hoá học. 3 8 Các yếu tố Nhận biết: ảnh hưởng - Nêu được các yếu tố ảnh hưởng đến tốc đến tốc độ độ phản ứng hoá học. phản ứng - Nêu được ý nghĩa của hệ số nhiệt độ Van’t hoá học Hoff (γ). 2 2 Thông hiểu: - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Vận dụng được kiến thức tốc độ phản ứng hoá học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen. - Chỉ ra được trạng thái, màu sắc, nhiệt độ Nguyên tố Tính chất nóng chảy, nhiệt độ sôi của các đơn chất nhóm VIIA vật lí và halogen. hoá học - Chỉ ra được hiện tượng của các thí nghiệm của các so sánh tính oxi hoá của các halogen. 4 đơn chất Thông hiểu: 3 2 1 6 nhóm VIIA - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen. - Tính thể tích khí chlorine (ở đktc) tạo thành trong phản ứng đơn giản. - So sánh được tính oxi hoá giữa các halogen. Vận dụng: - Bài tập liên quan đến tính chất hoá học của các đơn chất halogen. Hydrogen Nhận biết: halide và - Trình bày được xu hướng biến đổi tính một số acid của dãy hydrohalic acid. phản ứng - Chỉ ra được hiện tượng của phản ứng khi - của ion cho dung dịch AgNO3 tác dụng với ion X . halide - Nêu được ứng dụng của một số hydrogen halide. Thông hiểu: 3 2 1 6 - Tính khối lượng kim loại trong phản ứng đơn giản có HCl tham gia. - Viết được PTHH thể hiện tính chất hoá học của các acid HX. Vận dụng cao: - Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X- Tổng 16 12 2 1 31 Tỉ lệ % từng mức độ nhận thức 40% 30% 20% 10% 100% Tỉ lệ chung 70% 30% Lưu ý: - Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng. - Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận. - Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm/câu; số điểm của câu tự luận được quy định trong hướng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận. II. Ma trận đề kiểm tra cuối kì 2 - Hóa học 10 – Chân trời sáng tạo Mức độ nhận thức Tổng Vận dụng Tổng số TT Nội dung Đơn vị kiến thức Nhận biết Thông hiểu Vận dụng % cao câu kiến thức điểm TN TL TN TL TN TL TN TL TN TL Phản ứng Số oxi hóa 1 0 1 0 0 0 0 0 2 1 oxi hóa Phản ứng oxi hóa 1 20% 1 0 1 0 0 1 0 0 2 khử - khử Enthalpy tạo thành và biến 2 0 1 0 0 0 0 0 3 thiên enthalpy của Năng lượng 0 15% 2 phản ứng hoá học hoá học Ý nghĩa và cách 2 0 1 0 0 0 0 0 3 tính biến thiên enthalpy phản ứng hoá học Phương trình tốc độ phản ứng và 2 0 2 0 0 0 0 0 4 0 Tốc độ hằng số tốc độ 3 phản ứng phản ứng 20% hoá học Các yếu tố ảnh hưởng đến tốc độ 2 0 2 0 0 0 0 0 4 0 phản ứng hoá học Tính chất vật lí và hoá học của các 3 0 2 0 0 1 0 0 5 1 đơn chất nhóm Nguyên tố 4 VIIA 45% nhóm VIIA Hydrogen halide và một số phản 3 0 2 0 0 0 0 1 5 1 ứng của ion halide Tổng 16 0 12 0 0 2 0 1 28 3 Tỉ lệ % 40% 30% 20% 10% Tỉ lệ chung 70% 30% III. Hai đề minh họa thi cuối học kì II – bộ sách Chân trời sáng tạo (có đáp án) Sở GD- ĐT ĐỀ KIỂM TRA KẾT THÚC HỌC KÌ II TRƯỜNG THPT Năm học 2022 - 2023 Môn: Hóa học 10 Mã đề thi: 001 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) (Học sinh không được sử dụng tài liệu) Họ, tên học sinh:..................................................................... Lớp: ............................. Đề bài: Phần I: Trắc nghiệm (7 điểm) Câu 1: Số oxi hoá của nitrogen trong hợp chất KNO3 là A. +3. B. +5. C. +7. D. +2. Câu 2: Cho các phát biểu sau: (a) Số oxi hoá của nguyên tử trong các đơn chất bằng 0. (b) Số oxi hoá của kim loại kiềm trong hợp chất là +1. (c) Số oxi hoá của oxygen trong OF2 là -2. (d) Trong hợp chất, hydrogen luôn có số oxi hoá là +1. Số phát biểu đúng là A. 1. B. 2. C. 3. D. 4. Câu 3: Cho các phản ứng hoá học sau: (a) HCl + KOH → KCl + H2O. (b) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O. (c) 2HCl + Fe → FeCl2 + H2. (d) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. Số phản ứng oxi hoá – khử là A. 4. B. 3. C. 2. D. 1. Câu 4: Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây? A. SO2.B. H 2SO4. C. H2S.D. Na 2SO3. Câu 5: Cho phương trình nhiệt hóa học của phản ứng: o CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s) rH298 231,04kJ Phản ứng trên là phản ứng A. thu nhiệt. B. tỏa nhiệt. C. không có sự thay đổi năng lượng. D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh. Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 0 H2 (g) F2 (g) 2HF(g) rH298 546,00kJ 1 1 Giá trị H0 của phản ứng H (g) F (g) HF(g)là r 298 2 2 2 2 A. – 546 kJ. B. + 546 kJ. C. – 273 kJ. D. + 273 kJ. Câu 7: Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do A. xảy ra phản ứng tỏa nhiệt. B. xảy ra phản ứng thu nhiệt. C. xảy ra phản ứng trao đổi chất với môi trường. D. có sự giải phóng nhiệt lượng ra ngoài môi trường. Câu 8: Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là A. nhiệt tạo thành chuẩn của phản ứng. B. biến thiên enthalpy của phản ứng. C. enthalpy của phản ứng. D. năng lượng của phản ứng. Câu 9: Xét phản ứng đốt cháy methane: o CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) rH298 = – 890,3 kJ Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là A. – 74,8 kJ. B. 74,8 kJ. C. – 211,6 kJ. D. 211,6 kJ. Câu 10: Cho phản ứng sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g) Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là o o o o o A. rH298 f H298 (CH4 (g)) f H298 (Cl2 (g)) f H298 (CH3Cl(g)) f H298 (HCl(g)). o o o o o B. rH298 f H298 (CH3Cl(g)) f H298 (HCl(g)) f H298 (CH4 (g)) f H298 (Cl2 (g)). o C. rH298 Eb (CH4 ) Eb (Cl2 ) Eb (CH3Cl) Eb (HCl). o D. rH298 Eb (CH3Cl) Eb (HCl) Eb (CH4 ) Eb (Cl2 ). Câu 11: Tốc độ trung bình của phản ứng là A. tốc độ phản ứng tại một thời điểm nào đó. B. tốc độ được tính trong một khoảng thời gian phản ứng. C. biến thiên nồng độ của phản ứng. D. biến thiên khối lượng của phản ứng. Câu 12: Cho phản ứng hoá học: Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g) Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là A. 1,5 × 10-3 M/s. B. 1,0 × 10-3 M/s. C. 2,5 × 10-3 M/s. D. 2,0 × 10-3 M/s. Câu 13: Cho phản ứng đơn giản sau: CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g) Biểu thức tốc độ tức thời của phản ứng viết theo định luật tác dụng khối lượng là A. v = k C C . CHCl3 Cl2 B. v = k C C . CCl4 HCl C. v = C C . CHCl3 Cl2 D. v = C C . CCl4 HCl Câu 14: Phát biểu nào sau đây không đúng? A. Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp. B. Tốc độ phản ứng có thể nhận giá trị dương hoặc âm. C. Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó. D. Tốc độ phản ứng đốt cháy cồn (alcohol) lớn hơn tốc độ của phản ứng gỉ sắt. Câu 15: Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là A. áp suất. B. nhiệt độ. C. nồng độ. D. chất xúc tác. Câu 16: Khi nhiệt độ tăng thêm 10 oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC? A. 8. B. 16. C. 32. D. 64. Câu 17: Các enzyme là chất xúc tác, có chức năng: A. Giảm năng lượng hoạt hóa của phản ứng. B. Tăng năng lượng hoạt hóa của phản ứng. C. Tăng nhiệt độ của phản ứng. D. Giảm nhiệt độ của phản ứng. Câu 18: Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau: (1) Trộn đều bột potassium chlorate và xúc tác. (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu khí oxygen. (4) Nghiền nhỏ potassium chlorate. Số biện pháp dùng để tăng tốc độ phản ứng là A. 2.B. 3. C. 4.D. 5. Câu 19: Vị trí nhóm halogen trong bảng tuần hoàn là A. Nhóm VA. B. Nhóm VIA. C. Nhóm VIIA. D. Nhóm IVA. Câu 20: Nguyên tử chlorine không có khả năng thể hiện số oxi hoá A. +3. B. 0. C. +1. D. +2. Câu 21: Chất nào dưới đây có sự thăng hoa khi đun nóng? A. Cl2.B. I 2. C. Br2.D. F 2. Câu 22: Cho các phát biểu sau: (a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa. (b) Hydrofluoric acid là acid yếu. (c) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–. Trong các phát biểu trên, số phát biểu đúng là A. 2.B. 4. C. 3.D. 5. Câu 23: Cho phản ứng tổng quát sau: X2(g) + 2KBr(aq) → 2KX(aq) + Br2(aq) X có thể là chất nào sau đây? A. Cl2. B. I2. C. F2. D. O2. Câu 24: Chọn phương trình phản ứng đúng? A. Fe + 2HCl → FeCl2 + H2. B. 2Fe + 6HCl → 2FeCl3 + 3H2. C. 3Fe + 8HCl → FeCl2 + 2FeCl3 + 4H2. D. Cu + 2HCl → CuCl2 + H2. Câu 25: Liên kết trong hợp chất hydrogen halide là A. liên kết cộng hóa trị không phân cực. B. liên kết cho – nhận. C. liên kết ion. D. liên kết cộng hóa trị phân cực. Câu 26: Hydrohalic acid nào sau đây được dùng để khắc hoa văn lên thuỷ tinh? A. Hydrochloric acid. B. Hydrofluoric acid. C. Hydrobromic acid. D. Hydroiodic acid. Câu 27: Phản ứng giữa chất nào sau đây với dung dịch H 2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử? A. NaBr.B. KI. C. NaCl.D. NaI. Câu 28: Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là A. Na2CO3. B. AgCl. C. AgNO3. D. NaOH. Phần II: Tự luận (3 điểm) Câu 1 (1 điểm): Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử). to a) Cl2 + KOH KCl + KClO3 + H2O b) KI + H2SO4 → I2 + H2S + K2SO4 + H2O Câu 2 (1 điểm): Cho nhiệt độ sôi của các halogen như sau: Halogen F2 Cl2 Br2 I2 Nhiệt độ sôi (oC) -188 -35 59 184 Giải thích sự biến đổi nhiệt độ sôi từ fluorine đến iodine. Câu 3 (1 điểm): Cho 1,49 gam hỗn hợp X gồm: MgCO 3 và Zn vào một lượng vừa đủ dung dịch HCl. Sau phản ứng thu được dung dịch A và 0,4958 lít khí B ở đkc. Xác định % khối lượng của các chất trong X. Hướng dẫn giải đề số 001 1 - B 2 - B 3 - C 4 - C 5 - B 6 - C 7 - B 8 - B 9 - A 10 - C 11 - B 12 - C 13 - A 14 - B 15 - C 16 - A 17 - A 18 - B 19 - C 20 - D 21 - B 22 - C 23 - A 24 - A 25 - D 26 - B 27 - C 28 - C Câu 9: o o o o o rH298 = [ f H298 (CO2 (g)) f H298 (H2O(l)).2] - [ f H298 (CH4 (g)) f H298 (O2 (g)).2] o ⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [ f H298 (CH4 (g)) + 0.2] o ⇒ f H298 (CH4 (g)) = – 74,8 kJ. Câu 12: Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là 1 (0,4 0,6) v . 2,5 10 3 (M / s). 2 40 Câu 16: Áp dụng công thức: 40 70 1 v v 2 10 2 3 v v 2 1 1 8 1 Như vậy khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 8 lần. Phần II: Tự luận Câu 1: 0 1 5 to a) Cl2 KOH KCl KClO3 H2O Cl2 vừa là chất khử, vừa là chất oxi hoá. Ta có các quá trình: 0 5 Quá trình oxi hoá: Cl2 2Cl 10e 0 1 Quá trình khử: Cl2 2e 2Cl Phương trình được cân bằng: to 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O 1 6 0 2 b) K I H2 SO4 I2 H2 S K2SO4 H2O Chất khử: KI. Chất oxi hoá: H2SO4. 1 0 Quá trình oxi hoá: 2 I I2 2e 6 2 Quá trình khử: S 8e S Phương trình được cân bằng: 8KI + 5H2SO4 → 4I2 + H2S + 4K2SO4 + 4H2O Câu 2: Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals dẫn đến nhiệt độ sôi tăng. Câu 3: 0,4958 nB = = 0,02 mol 24,79 Gọi số mol MgCO3 là x (mol), số mol Zn là y (mol). Phương trình hoá học: MgCO3 + 2HCl → MgCl2 + CO2 + H2O x 2x x x mol Zn + 2HCl → ZnCl2 + H2 y 2y y y mol Ta có hệ phương trình: mx 1,49g 84x 65y 1,49 x 0,01 nB 0,02mol x y 0,02 y 0,01 0,01.84 %m .100% 56,38%. MgCO3 1,49 %mZn = 100% – 56,38% = 43,62%. Sở GD- ĐT ĐỀ KIỂM TRA KẾT THÚC HỌC KÌ II TRƯỜNG THPT Năm học 2022 - 2023 Môn: Hóa học 10 Mã đề thi: 002 Bộ: Chân trời sáng tạo Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 3 câu tự luận) (Học sinh không được sử dụng tài liệu) Họ, tên học sinh:..................................................................... Lớp: ............................. Đề bài: Phần I: Trắc nghiệm (7 điểm) Câu 1: Số oxi hoá của sulfur trong hợp chất H2SO3 là A. +2. B. +4. C. +6. D. +8. Câu 2: Cho các hợp chất sau: N2, N2O, NH3, HNO3, (NH4)2CO3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là A. 4. B. 3. C. 2. D. 1. Câu 3: Cho các phản ứng hoá học sau: (a) 2HCl + Fe → FeCl2 + H2. (b) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. (c) HCl + KOH → KCl + H2O. (d) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O. Số phản ứng trong đó HCl thể hiện tính khử là A. 1. B. 2. C. 3. D. 4. Câu 4: Nguyên tử nitrogen chỉ thể hiện tính oxi hoá (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây? A. N2. B. NH3. C. NO. D. NaNO3. Câu 5: Cho phương trình nhiệt hóa học của phản ứng: to o C(s) + H2O(g) CO(g) + H2(g) rH298 131,25kJ Phản ứng trên là phản ứng A. thu nhiệt. B. không có sự thay đổi năng lượng. C. tỏa nhiệt. D. có sự giải phóng nhiệt lượng ra môi trường. Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau: 1 CO(g) O (g) CO (g) H0 283,00kJ 2 2 2 r 298 0 Giá trị rH298 của phản ứng 2CO(g) + O2(g) → 2CO2(g) là A. – 283 kJ. B. + 283 kJ. C. + 566 kJ. D. – 566 kJ. Câu 7: Phản ứng nảo sau đây là phản ứng tỏa nhiệt? A. Phản ứng nhiệt phân thuốc tím (KMnO4). B. Phản ứng nhiệt phân Fe(OH)3. C. Phản ứng đốt cháy cồn (ethanol). D. Phản ứng nung NH4Cl(s) tạo ra NH3(g) và HCl(g). Câu 8: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)? A. 2C(than chì) + O2(g) → 2CO(g). B. C(than chì) + O(g) → CO(g). 1 C. C(than chì) + O (g) CO(g) . 2 2 D. C(than chì) + CO2(g) → 2CO(g). Câu 9: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau: 2NO2(g) (đỏ nâu) → N2O4(g) (không màu) o Biết NO2 và N2O4 có f H298 tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng A. tỏa nhiệt, N2O4 bền vững hơn NO2. B. thu nhiệt, N2O4 bền vững hơn NO2. C. tỏa nhiệt, NO2 bền vững hơn N2O4. D. thu nhiệt, NO2 bền vững hơn N2O4. Câu 10: Cho phản ứng tổng hợp ammonia (NH3) như sau: 0 N2(g) + 3H2(g) → 2NH3(g) rH298 –92 kJ. Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là A. 391 kJ/mol. B. 361 kJ/mol. C. 245 kJ/mol. D. 490 kJ/mol. Câu 11: Tốc độ phản ứng viết theo định luật tác dụng khối lượng là A. tốc độ trung bình của phản ứng. B. tốc độ tức thời của phản ứng. C. tốc độ tính trung bình trong một khoảng thời gian phản ứng. D. tốc độ tính theo chất sản phẩm phản ứng. Câu 12: Đối với phản ứng: A 3B 2C, phát biểu nào sau đây đúng? A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C. B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C. C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C. D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C. Câu 13: Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) → 2HI(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là C A. v H2 . t C B. v I2 . t C. v kC C . H2 I2 C D. v HI . t Câu 14: Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào? A. Bắt đầu phản ứng. B. Khi phản ứng được một nửa lượng chất so với ban đầu. C. Gần cuối phản ứng. D. Không xác định được. Câu 15: Yếu tố nào được sử dụng để tăng tốc độ phản ứng trong trường hợp sau: “Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh (sulfur) đang cháy ngoài không khí vào lọ đựng khí oxygen”? A. Nồng độ. B. Áp suất. C. Nhiệt độ. D. A, B, C đều đúng. Câu 16: Hệ số nhiệt độ Van’t Hoff được kí hiệu là A. ∝. B. γ. C. φ.D. θ. Câu 17: Chất làm tăng tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là A. chất ức chế.
File đính kèm:
 de_kiem_tra_ket_thuc_hoc_ki_ii_hoa_hoc_10_ma_de_001002_nam_h.docx
de_kiem_tra_ket_thuc_hoc_ki_ii_hoa_hoc_10_ma_de_001002_nam_h.docx

