Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 310 - Năm học 2022-2023 - Nguyễn Quế Sơn (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 310 - Năm học 2022-2023 - Nguyễn Quế Sơn (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra kết thúc học kì II Hóa học 10 - Mã đề 310 - Năm học 2022-2023 - Nguyễn Quế Sơn (Có đáp án + Ma trận)
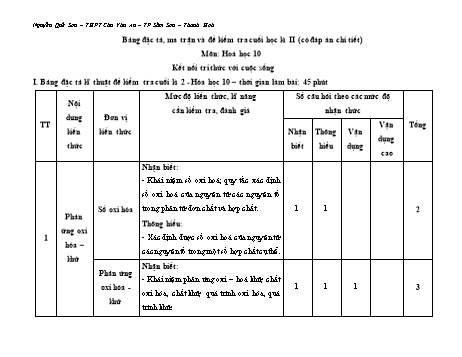
Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Bảng đặc tả, ma trận và đề kiểm tra cuối học kì II (có đáp án chi tiết) Môn: Hoá học 10 Kết nối tri thức với cuộc sống I. Bảng đặc tả kĩ thuật đề kiểm tra cuối kì 2 - Hóa học 10 – thời gian làm bài: 45 phút Mức độ kiến thức, kĩ năng Số câu hỏi theo các mức độ Nội cần kiểm tra, đánh giá nhận thức dung Đơn vị TT Vận Tổng kiến kiến thức Nhận Thông Vận dụng thức biết hiểu dụng cao Nhận biết: - Khái niệm số oxi hoá; quy tắc xác định số oxi hoá của nguyên tử các nguyên tố Số oxi hóa trong phân tử đơn chất và hợp chất. 1 1 2 Phản Thông hiểu: ứng oxi 1 - Xác định được số oxi hoá của nguyên tử hóa – các nguyên tố trong một số hợp chất cụ thể. khử Nhận biết: Phản ứng - Khái niệm phản ứng oxi – hoá khử, chất oxi hóa - 1 1 1 3 oxi hóa, chất khử, quá trình oxi hóa, quá khử trình khử. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Thông hiểu: - Xác định được chất oxi hoá, chất khử, quá trình oxi hoá, quá trình khử trong phản ứng oxi hoá khử. Vận dụng - Lập được phương trình hoá học của một số phản ứng oxi hóa - khử. Nhận biết: Phản ứng - Nhận biết được một phản ứng là phản hoá học và ứng toả nhiệt hay thu nhiệt. Năng biến thiên - Trình bày được khái niệm phản ứng toả 2 lượng 2 1 3 enthalpy nhiệt, thu nhiệt; điều kiện chuẩn. hoá học của phản Thông hiểu: ứng - Đếm số phát biểu đúng/sai liên quan đến biến thiên enthalpy của phản ứng. Ý nghĩa và Nhận biết: cách tính - Nêu được ý nghĩa của dấu và giá trị 0 biến thiên rH298 . 2 1 1 4 enthalpy của phản Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá ứng hoá - Dựa vào biến thiên enthalpy của phản học ứng xác định phản ứng là toả nhiệt hay thu nhiệt. Thông hiểu: - Đếm số phát biểu đúng sai liên quan đến ý nghĩa biến thiên enthalpy của phản ứng. Vận dụng cao: 0 - Tính được r H 298 của một phản ứng dựa vào bảng số liệu năng lượng liên kết hoặc nhiệt tạo thành cho sẵn. Tốc độ Tốc độ Nhận biết: phản phản ứng - Trình bày được khái niệm tốc độ phản ứng hoá hoá học ứng hoá học và cách tính tốc độ trung học bình của phản ứng. 3 - Viết được biểu thức tốc độ phản ứng 4 4 8 theo hằng số tốc độ phản ứng và nồng độ. - Nêu được ý nghĩa của hệ số nhiệt độ Van’t Hoff (γ). Thông hiểu: Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá - Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. - Tính được tốc độ trung bình của một phản ứng hoá học. -Vận dụng được kiến thức tốc độ phản ứng hoá học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất. Nhận biết: - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen. - Chỉ ra được trạng thái, màu sắc, nhiệt độ Nguyên Nguyên tố nóng chảy, nhiệt độ sôi của các đơn chất tố nhóm và đơn halogen. 4 3 2 1 6 halogen chất - Chỉ ra được hiện tượng của các thí halogen nghiệm so sánh tính oxi hoá của các halogen. Thông hiểu: - Viết sản phẩm phản ứng thể hiện tính chất của đơn chất halogen. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá - Tính thể tích khí chlorine (ở đkc) tạo thành trong phản ứng đơn giản. - So sánh được tính oxi hoá giữa các halogen. Vận dụng: - Bài tập liên quan đến tính chất hoá học của các đơn chất halogen. Hydrogen Nhận biết: halide, - Trình bày được xu hướng biến đổi tính hydrohalic acid của dãy hydrohalic acid. acid và - Chỉ ra được hiện tượng của phản ứng khi muối cho dung dịch AgNO3 tác dụng với ion halide halide. 3 2 1 6 - Nêu được ứng dụng của một số hydrogen halide. Thông hiểu: - Tính khối lượng/thể tích (đkc) chất tham gia/ sản phẩm trong phản ứng đơn giản có HCl tham gia. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá - Viết được phương trình hoá học thể hiện tính chất hoá học của các acid HX. Vận dụng cao: - Vận dụng giải bài tập liên quan đến hydrohalic acid, ion halide X- Tổng 16 12 2 2 32 Tỉ lệ % từng mức độ nhận 40% 30% 20% 10% 100% thức Tỉ lệ chung 70% 30% Lưu ý: - Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng. - Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận. - Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm/câu; số điểm của câu tự luận được quy định trong hướng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá 2. Ma trận đề kiểm tra cuối kì 2 - Hóa học 10 – Thời gian làm bài: 45 phút Mức độ nhận thức Tổng Thông Vận dụng Tổng số % điểm Nhận biết Vận dụng hiểu cao câu TT Đơn vị kiến thức Nội dung Số Số Số Số Số Số Số Số kiến thức câu câu câu câu câu câu câu câu TN TL TN TL TN TL TN TL TN TL 1 Phản ứng Số oxi hóa 1 0 1 0 0 0 0 0 2 1 oxi hóa Phản ứng oxi hóa - 20% 1 0 1 0 0 1 0 0 2 khử khử Phản ứng hoá học và 2 Năng biến thiên enthalpy 2 0 1 0 0 0 0 0 3 lượng hoá của phản ứng học Ý nghĩa và cách tính 1 20% biến thiên enthalpy 2 0 1 0 0 0 0 1 3 của phản ứng hoá học Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá 3 Tốc độ Tốc độ phản ứng phản ứng hoá học 4 0 4 0 0 0 0 0 8 0 20% hoá học 4 Nguyên tố Nguyên tố và đơn 3 0 2 0 0 1 0 0 5 1 nhóm chất halogen halogen Hydrogen halide, 40% hydrohalic acid và 3 0 2 0 0 0 0 1 5 1 muối halide Tổng 16 0 12 0 0 2 0 2 28 4 Tỉ lệ % 40% 30% 20% 10% 100% Tỉ lệ chung 70% 30% 100% Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Sở GD- ĐT THANH HOÁ ĐỀ KIỂM TRA KẾT THÚC HỌC KÌ II TRƯỜNG THPT CHU VĂN AN Môn: Hóa học 10 Bộ Sách: Kết nối tri thức với cuộc sống Mã đề thi: 310 Thời gian làm bài: 45 phút; (28 câu trắc nghiệm – 4 câu tự luận) Phần I: Trắc nghiệm (7 điểm) Câu 1. Trong đơn chất, số oxi hóa của nguyên tử luôn bằng A. 0. B. +1. C. 2. D. 1. Câu 2. Số oxi hóa của nguyên tử S trong hợp chất SO2 là A. +2. B. +4. C. +6. D. 1. Câu 3. Phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và nhận A. electron. B. neutron. C. proton. D. cation. Câu 4. Cho phản ứng oxi hoá – khử sau: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu Trong phản ứng này, chất khử là A. Cu. B. Fe(NO3)2. C. Fe. D. Cu(NO3)2. Câu 5. Phản ứng hấp thụ năng lượng dưới dạng nhiệt được gọi là A. phản ứng cháy. B. phản ứng toả nhiệt. C. phản ứng oxi hoá – khử. D. phản ứng thu nhiệt. Câu 6. Cho phương trình nhiệt học sau: o 2H2(g) + O2(g) → 2H2O(l) rH298 571,6kJ Nhận xét nào sau đây là đúng? A. Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng thu vào nhiệt lượng 571,6 kJ. B. Phản ứng đốt cháy 2 mol khí hydrogen bằng 1 mol khí oxygen, tạo thành 2 mol nước ở trạng thái lỏng toả ra nhiệt lượng 571,6 kJ. C. Phản ứng tạo thành 1 mol nước ở trạng thái lỏng thu vào nhiệt lượng 571,6 kJ. D. Phản ứng tạo thành 1 mol nước ở trạng thái lỏng toả ra nhiệt lượng 571,6 kJ. Câu 7. Điều kiện: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và nhiệt độ 25 oC (hay 298 K) được gọi là A. điều kiện chuẩn. B. điều kiện tiêu chuẩn. C. điều kiện an toàn. D. điều kiện thí nghiệm. Câu 8. Cho phương trình nhiệt hoá học sau: 0 N2(g) + 3H2(g) → 2NH3(g) rH298 = – 91,8 kJ Biến thiên enthalpy chuẩn của phản ứng: 2NH3(g) → N2(g) + 3H2(g) là A. -45,9 kJ. B. +45,9 kJ. C. – 91,8 Kj D. +91,8 kJ. Câu 9. Cho các chất sau, chất nào có nhiệt tạo thành chuẩn khác 0? A. N2(g). B. S(s). C. Na(s). D. O2(l). Câu 10. Ở điều kiện chuẩn, công thức tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành là 0 0 0 0 0 0 A. rH298 f H298 (sp) f H298 (cd) . B. rH298 f H298 (cd) f H298 (sp) . 0 0 0 0 0 0 C. f H298 rH298 (sp) rH298 (cd) . D. f H298 rH298 (cd) rH298 (sp) . Câu 11. Tốc độ phản ứng hoá học là A. sự thay đổi nồng độ của một chất phản ứng trong một đơn vị thời gian. B. sự thay đổi nồng độ của một sản phẩm phản ứng trong một đơn vị thời gian. C. sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian. D. sự thay đổi khối lượng của các chất đầu trong một đơn vị thời gian. Câu 12. Việc làm nào dưới đây thể hiện sự ảnh hưởng của diện tích bề mặt đến tốc độ của phản ứng: Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g) A. Pha loãng dung dịch HCl. B. Thay sắt (iron) viên bằng sắt bột. C. Sử dụng chất xúc tác. D. Tăng nhiệt độ của phản ứng. Câu 13. Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau: (1) Dùng chất xúc tác manganese dioxide (2) Nung ở nhiệt độ cao. (3) Dùng phương pháp dời nước để thu được khí oxygen. (4) Đập nhỏ potassium chlorte. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá (5) Trộn đều bột potassium chlorate và xúc tác. Số biện pháp dùng để tăng tốc độ phản ứng là A. 2.B. 3. C. 4. D. 5. Câu 14. Cho phản ứng đơn giản sau: 2NO + O2 → 2NO2. Mối liên hệ giữa tốc độ phản ứng và nồng độ các chất tham gia phản ứng là 2 A. v k.C .C . B. v k.C .C . C. v 2k.C .C . D. v k.2C .C . NO O 2 NO O 2 NO O 2 NO O 2 Câu 15. Cho các phản ứng hoá học sau: to ,xt (1) N2(g) + 3H2(g) 2NH3(g) (2) CO2(g) + Ca(OH)2(aq) → CaCO3(s) + H2O(l) (3) SiO2(s) + CaO(s) → CaSiO3(s) (4) BaCl2(aq) + H2SO4(aq) → BaSO4(s) + 2HCl(aq) Áp suất ảnh hưởng đến tốc độ phản ứng nào? A. (1). B. (1) và (2). C. (1) và (3). D. (3) và (4). Câu 16. Cho phương trình phản ứng tổng quát sau: A + B → C. Tốc độ phản ứng tại một thời điểm được tính bằng biểu thức: v = k.CA.CB. Hằng số tốc độ k phụ thuộc vào A. nồng độ của chất đầu.B. nồng độ của chất sản phẩm. C. nhiệt độ của phản ứng.D. thời gian xảy ra phản ứng. Câu 17. Nhận xét nào sau đây là đúng? A. Khi nồng độ chất tan trong dung dịch tăng, tốc độ phản ứng tăng. B. Với mọi phản ứng, khi tăng áp suất, tốc độ phản ứng tăng. C. Chất xúc tác làm ức chế phản ứng. D. Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ nghịch với áp suất của nó. Câu 18. Cho bột Zn vào dung dịch HCl loãng. Sau đó đun nóng hỗn hợp này. Phát biểu nào sau đây không đúng? A. Khí H2 thoát ra nhanh hơn. B. Bột Zn tan nhanh hơn. C. Nồng độ HCl giảm nhanh hơn. D. Lượng muối thu được nhiều hơn. Câu 19. Nguyên tố nào sau đây không thuộc nhóm halogen? A. B. B. F. C. Br. D. I. Câu 20. Halogen nào sau đây, điều kiện thường ở trạng thái rắn? A. Fluorine. B. Bromine. C. Iodine. D. Chlorine. Câu 21. Phương trình hoá học nào sau đây sai? to A. H2 + F2 → 2HF. B. Fe + Cl2 FeCl2. C. Cl2 + H2O ⇌ HCl + HClO. D. Br2 + 2NaI → 2NaBr + I2. Câu 22. Nguyên tố nào sau đây có tính oxi hoá mạnh nhất? A. Fluorine. B. Chlorine. C. Chromium. D. Bromine. Câu 23. Cho một lượng Br2 tác dụng với kim loại đồng (copper) sau phản ứng thấy thu được 11,2 gam muối. Khối lượng bromine tham gia phản ứng là A. 4 gam. B. 8 gam. C. 6 gam. D. 10 gam. Câu 24. Trong các acid sau: HF, HCl, HBr, HI. Acid mạnh nhất là A. HF. B. HCl. C. HBr. D. HI. Câu 25. Hóa chất dùng để phân biệt các dung dịch: HF, NaCl, KBr là A. dung dịch HCl. B. quỳ tím. C. dung dịch AgNO3. D. dung dịch BaCl2. Câu 26. Chất nào sau đây được ứng dụng để khắc chữ lên thuỷ tinh? A. Cl2. B. HCl. C. F2. D. HF. Câu 27. Hòa tan 1,2 gam magnesium trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H 2 ở điều kiện chuẩn là A. 0,2479 lít. B. 0,4958 lít. C. 0,5678 lít. D. 1,2395 lít. Câu 28. Cho muối halide nào sau đây tác dụng với dung dịch H2SO4 đặc, nóng thì chỉ xảy ra phản ứng trao đổi? A. KBr. B. KI. C. NaCl. D. NaBr. Phần II: Tự luận (3 điểm) Câu 29 (1 điểm). Lập phương trình hoá học của các phản ứng oxi hoá – khử sau, chỉ rõ chất oxi hoá, chất khử: a) NH3 + O2 → NO + H2O b) FeO + HNO3 → Fe(NO3)3 + NO + H2O. Câu 30 (0,5 điểm). Cho phản ứng nhiệt học sau: o 4FeS2(s) + 11O2(g) → aFe2O3(s) + bSO2(g) rH298 Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Tìm a, b và tính biến thiên enthalpy của phản ứng ở điều kiện chuẩn biết nhiệt tạo thành của các chất trong phản ứng được cho ở bảng sau: Chất FeS2(s) O2(g) Fe2O3(s) SO2(g) o -177,9 0 -825,5 -296,8 f H298 (kJ/mol) Câu 31 (0,5 điểm). Cho 1,03 gam muối sodium halide (A) tác dụng với dung dịch AgNO 3 dư thì thu được một kết tủa. Kết tủa sau khi phân huỷ hoàn toàn cho 1,08 gam silver (bạc). Xác định tên muối (A). Câu 32 (1 điểm). Nung nóng một bình bằng thép có chứa 0,04 mol H2 và 0,04 mol Cl2 để thực hiện phản ứng, thu được 0,072 mol khí HCl. Tính hiệu suất của phản ứng tạo thành HCl. .Hết Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Đáp án và hướng dẫn giải Phần I: Trắc nghiệm 1 - A 2 - B 3 - A 4 - C 5 - D 6 - B 7 - A 8 - D 9 - D 10 - A 11 - C 12 - B 13 - C 14 - B 15 - B 16 - C 17 - A 18 - D 19 - A 20 - C 21 - B 22 - A 23 - B 24 - D 25 - C 26 - D 27 - D 28 - C Câu 4: Đáp án đúng là: C 0 2 2 0 Fe Cu NO Fe NO Cu 3 2 3 2 Số oxi hoá của Fe tăng từ 0 lên +2, do đó Fe là chất khử. Câu 9: Đáp án đúng là: D Nhiệt tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0. Nhiệt tạo thành chuẩn của O2(l) khác 0, do trạng thái lỏng không phải là trạng thái bền vững nhất của oxygen. Câu 13: Đáp án đúng là: C MnO2 , t Phương trình hóa học: 2KClO3 2KCl + 3O2 Các biện pháp làm tăng tốc độ phản ứng là (1), (2), (4), (5). Câu 15: Đáp án đúng là: B Áp suất ảnh hưởng đến tốc độ của phản ứng (1) và (2). Phản ứng (3) và (4) không có chất khí tham gia nên việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng. Câu 16: Đáp án đúng là: C Đại lượng k đặc trưng cho mỗi phản ứng và phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ của chất phản ứng. Câu 17: Đáp án đúng là: A Khi nồng độ chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn tới tốc độ phản ứng tăng. Câu 18: Đáp án đúng là: D Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Đun nóng phản ứng làm tốc độ phản ứng tăng ⇒ Khí H 2 thoát ra nhanh hơn, bột Zn tan nhanh hơn, nồng độ HCl giảm nhanh hơn, thu được muối nhanh hơn. Câu 19: Đáp án đúng là: A Nhóm halogen gồm các nguyên tố: fluorine (F); chlorine (Cl); bromine (Br); iodine (I), astatine (At) và tennessine (Ts). Nguyên tố B (boron) không thuộc nhóm halogen. Câu 20: Đáp án đúng là: C Halogen Fluorine Chlorine Bromine Iodine Trạng thái khí khí lỏng rắn Câu 21: Đáp án đúng là: B Dây sắt (iron) nung đỏ sẽ bốc cháy trong khí chlorine, tạo thành khói màu nâu đỏ là iron(III) chloride. to Phương trình hoá học: 2Fe + 3Cl2 2FeCl3. Câu 22: Đáp án đúng là: A Halogen là các phi kim điển hình, có tính oxi hoá mạnh, tính oxi hoá giảm dần từ fluorine đến iodine ⇒ Halogen có tính oxi hoá mạnh nhất là fluorine. Câu 23: Đáp án đúng là: B Phương trình hoá học: Cu + Br2 → CuBr2. Ta có: 11,2 n n 0,05(mol). Br2 CuBr2 64 80.2 Khối lượng bromine tham gia phản ứng là: m = 0,05.160 = 8 (gam). Câu 24: Đáp án đúng là: D Trong dãy hydrohalic acid, tính acid tăng từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh). Câu 25: Đáp án đúng là: C Sử dụng dung dịch AgNO3: - Nếu không có hiện tượng xuất hiện → HF. - Nếu xuất hiện kết tủa trắng → NaCl. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá AgNO3 + NaCl → AgCl + NaNO3. - Nếu xuất hiện kết tủa vàng → KBr. AgNO3 + KBr → AgBr + KNO3. Câu 26: Đáp án đúng là: D Hydrofluoric acid có khả năng đặc biệt là ăn mòn thuỷ tinh vô cơ, do xảy ra phản ứng: SiO2 + 4HF → SiF4 + 2H2O Do đó HF được ứng dụng để khắc chữ lên thuỷ tinh. Câu 27: Đáp án đúng là: D 1,2 n 0,05(mol); Mg 24 Phương trình hoá học: Mg + 2HCl → MgCl2 + H2 Theo phương trình hoá học có: n n 0,05(mol) V 0,05.24,79 1,2395(L). H2 Mg H2 Câu 28: Đáp án đúng là: C NaCl tác dụng với H2SO4 đặc chỉ xảy ra phản ứng trao đổi. 2NaCl + H2SO4 → Na2SO4 + 2HCl. Phần II: Tự luận Câu 29: 3 0 2 2 a) NH3 O2 NO H2 O Chất oxi hoá: O2; chất khử: NH3. Ta có: 3 2 4 N N 5e 5 0 2 O2 4e 2O Phương trình hoá học được cân bằng: 4NH3 + 5O2 → 4NO + 6H2O. 2 5 3 2 b) FeO H NO Fe NO NO H O 3 3 3 2 Chất oxi hoá: HNO3; chất khử: FeO. Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá Ta có: 2 3 3 Fe Fe 1e 1 5 2 N 3e N Phương trình hoá học được cân bằng: 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O. Câu 30: a = 2; b = 8. 4FeS2(s) + 11O2(g) → 2Fe2O3(s) + 8SO2(g) Ta có: o o o rH298 f H298 (sp) f H298 (cd) 2.( 825,5) 8.( 296,8) 4.( 177,9) 3313,8(kJ). Câu 31: Đặt công thức hoá học của muối (A) là: NaX. Ta có các phương trình: NaX + AgNO3 → AgX + NaNO3 2AgX → 2Ag + X2 Dựa vào phương trình hoá học ta có: 1,08 n n n 0,01(mol) NaX AgX Ag 108 1,03 M 103 23 M NaX 0,01 X MX = 80. Vậy X là Br (bromine). Muối (A) là NaBr (sodium bromide). Câu 32: Phương trình hóa học: H2 Cl2 2HCl Bd(mol) : 0,04 0,04 0 Pu(mol) : 0,036 0,036 0,072 Hiệu suất phản ứng là: Nguyễn Quế Sơn – THPT Chu Văn An – TP Sầm Sơn – Thanh Hoá 0,036 H .100% 90% 0,04
File đính kèm:
 de_kiem_tra_ket_thuc_hoc_ki_ii_hoa_hoc_10_ma_de_310_nam_hoc.docx
de_kiem_tra_ket_thuc_hoc_ki_ii_hoa_hoc_10_ma_de_310_nam_hoc.docx

