Đề tham khảo giữa học kì II Hóa học 10 - Kim Thoa (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề tham khảo giữa học kì II Hóa học 10 - Kim Thoa (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề tham khảo giữa học kì II Hóa học 10 - Kim Thoa (Có đáp án + Ma trận)
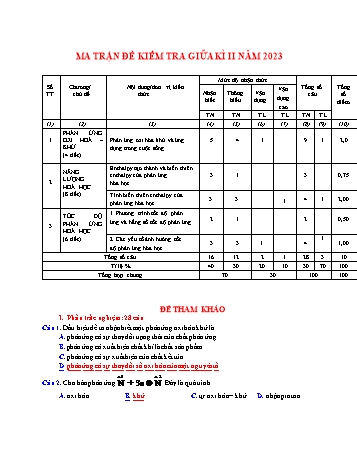
MA TRẬN ĐỀ KIỂM TRA GIỮA KÌ II NĂM 2023 Mức độ nhận thức Số Chương/ Nội dung/đơn vị kiến Vận Tổng số Tổng TT chủ đề thức Nhận Thông Vận câu số dụng biết hiểu dụng điểm cao TN TN TL TL TN TL (1) (2) (3) (4) (5) (6) (7) (8) (9) (10) PHẢN ỨNG 1 OXI HOÁ – Phản ứng oxi hóa khử và ứng 5 4 1 9 1 2,0 KHỬ dụng trong cuộc sống. (4 tiết) Enthalpy tạo thành và biến thiên NĂNG enthalpy của phản ứng 3 1 3 0,75 LƯỢNG 2 hóa học HOÁ HỌC (8 tiết) Tính biến thiên enthalpy của 3 3 4 1 2,00 phản ứng hóa học 1 1. Phương trình tốc độ phản TỐC ĐỘ ứng và hằng số tốc độ phản ứng 2 1 2 0,50 3 PHẢN ỨNG HOÁ HỌC (6 tiết) 2. Các yếu tố ảnh hưởng tốc 1 3 3 1 4 1,00 độ phản ứng hóa học Tổng số câu 16 12 2 1 28 3 10 Tỉ lệ % 40 30 20 10 30 70 100 Tổng hợp chung 70 30 100 100 ĐỀ THAM KHẢO I. Phần trắc nghiệm: 28 câu Câu 1. Dấu hiệu để ta nhận biết một phản ứng oxi hóa khử là A. phản ứng có sự thay đổi trạng thái của chất phản ứng. B. phản ứng có xuất hiện chất khí là chất sản phẩm. C. phản ứng có sự xuất hiện của chất kết tủa. D. phản ứng có sự thay đổi số oxi hóa của một nguyên tố. + 5 + 2 Câu 2. Cho bán phản ứng N + 3e ® N . Đây là quá trình A. oxi hóa.B. khử. C. tự oxi hóa – khử. D. nhận proton. Câu 3. Số oxi hóa của Mn trong đơn chất Mn, của Fe trong FeCl 3, của S trong SO3, của P trong 3- PO4 lần lượt là A. 0, +3, +6, +5. B. 0, +3, +5, +6. C. 0, +3, +5, +4. D. 0, +5, +3, +5. Câu 4. Quá trình oxy hoá là A. quá trình cho electron. B. quá trình nhận electron. C. quá trình tăng electron. D. quá trình tăng số oxy hoá. Câu 5. Trong các phản ứng hoá học sau, phản ứng không phải phản ứng oxi hoá – khử là A. Fe + 2HCl → FeCl2 + H2.B. AgNO 3 + HCl → AgCl + HNO3. C. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O. D. 6FeCl2 + KClO3 + 6HCl → 6FeCl 3 + KCl + 3H2O. Câu 6. Vai trò của các chất tham gia sơ đồ phản ứng oxi hóa khử sau: KMnO4 + HCl ----® KCl + MnCl2 + Cl2 + H2O A. KMnO4 là chất oxi hóa.B. HCl là chất khử. C. KMnO4 là môi trường. D. HCl vừa là chất oxi hóa, vừa là chất khử. Câu 7. Cho các phản ứng xảy ra sau: 2FeBr2 + Br2 ® 2FeBr3; 2NaBr + Cl2 ® 2NaCl + Br2 . Phát biểu đúng là - - A. Tính khử của Cl mạnh hơn của Br . B. Tính oxi hóa của Br2 mạnh hơn của Cl2. - 2+ 3+ C. Tính khử của Br mạnh hơn của Fe .D. Tính oxi hóa của Cl 2 mạnh hơn của Fe . Câu 8. Hòa tan 3,2 g đồng trong dung dịch HNO 3 đặc, dư, đun nóng thu được V lít NO 2 (đktc). Giá trị của V là A. 1,12.B. 2,24. C. 3,36. D. 4,48. Câu 9. Cho một đinh sắt vào ống nghiệm đựng khoảng 2 ml dung dịch CuSO4 loãng. Hiện tượng xảy ra là: A. đinh sắt tan ra.B. có một lớp đồng đỏ bám ngoài đinh sắt. C. màu xanh của dung dịch đậm lên. D. dung dịch chuyển sang màu vàng. Câu 10. Phản ứng tỏa nhiệt là gì? A. Là phản ứng phóng năng lượng dạng nhiệt. B. Là phản ứng hấp thụ năng lượng dạng nhiệt. C. Là phản ứng hấp thụ ion dưới dạng nhiệt. D. Là phản ứng hấp thụ ion dưới dạng nhiệt. Câu 11. Trong các quá trình sao quá trình nào là quá trình thu nhiệt: A. Vôi sống tác dụng với nước. B. Đốt than đá. C. Đốt cháy cồn.D. Nung đá vôi. Câu 12. Cho 2 phương trình nhiệt hóa học sau: 표 C (s) + H2O (g) → CO (g) + H2 (g) ∆푡H298 = +121,25 kJ (1). 표 CuSO4 (aq) + Zn (s) → ZnSO4 (aq) + Cu (s) ∆푡H298 = -230,04 kJ (2). Chọn phát biểu đúng: A. Phản ứng (1) là phản ứng tỏa nhiệt, phản ứng 2 là phản ứng thu nhiệt. B. Phản ứng (1) là phản ứng thu nhiệt, phản ứng 2 là phản ứng tỏa nhiệt. C. Phản ứng (1) và (2) là phản ứng thu nhiệt. D. Phản ứng (1) và (2) là phản ứng tỏa nhiệt. Câu 13. Sự . liên kết cần cung cấp năng lượng, sự liên kết giải phóng năng lượng. Cụm từ thích hợp điền vào chỗ trống: A. hình thành; phá vỡ.B. phá vỡ; hình thành. C. hình thành; hình thành. D. phá vỡ; phá vỡ. Hd: Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết giải phóng năng lượng. Câu 14. Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: o N2 (g) + O2 (g) → 2NO (g) ∆tH 298K = +180 kJ. Kết luận nào sau đây là đúng A. Nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ thấp; B. Phản ứng tỏa nhiệt; C. Phản ứng xảy ra thuận lợi hơn ở điều kiện thường; D. Phản ứng hóa học xảy ra có sự hấp thụ nhiệt năng từ môi trường. Câu 15. Cho phản ứng: 1/2N2(g) + 3/2H2(g) →NH3(g). Biết enthalpy tạo thành chuẩn của NH3 là -1 –45,9 kJ mol . Để thu được 2 mol NH3 ở cùng điều kiện phản ứng thì A. lượng nhiệt tỏa ra là –45,9 kJ. B. lượng nhiệt thu vào là 45,9 kJ. C. lượng nhiệt tỏa ra là 91,8 kJ. D. lượng nhiệt thu vào là 91,8 kJ. 표 -1 HD: Phương trình phản ứng: 1/2N2(g) + 3/2H2(g) →NH3(g) ∆ H298= –45,9 kJ mol . Để tạo thành 1 mol NH3 thì lượng nhiệt tỏa ra là 45,9 kJ. →Để tạo thành 2 mol NH3 thì lượng nhiệt tỏa ra là: 2×(45,9) = 91,8 kJ. Câu 16. Cho phản ứng: H2(g) + Cl2(g) →2HCl(g). Ở điều kiện chuẩn, cứ 1 mol H 2 phản ứng hết sẽ tỏa ra -184,6 kJ. Tính enthalpy tạo thành chuẩn của HCl(g). A. 92,3 kJ mol-1.B. –92,3 kJ mol -1. C. 184,6 kJ mol-1. D. –184,6 kJ mol- HD: 1 mol H2(g) phản ứng hết tạo thành 2 mol HCl(g) thì lượng nhiệt tỏa ra là 184,6 kJ. →Để tạo thành 1 mol HCl(g) thì lượng nhiệt tỏa ra là: 1×184,621/2= 92,3 kJ. Vậy, enthalpy tạo thành chuẩn của HCl(g) là –92,3 kJ mol-1. Câu 17. Tính biến thiên enthalpy của phản ứng đốt cháy hoàn toàn 1 mol ethane (C2H6). C2H6(g) + 7/2O2(g) →2CO2(g) + 3H2O(l) 표 -1 표 -1 표 Biết: ∆ H298 (C2H6) = -84,0 kJ mol ; ∆ H298 (CO2) = -393,5 kJ mol ; ∆ H298 (H2O) = -285,8 kJ mol-1. A. 256,8 kJ. B. -256,8 kJ. C. -1560,4 kJ.D. 1560,4 kJ. 표 -1 HD: ∆ H298 (O2) = 0 kJ mol (đơn chất). Biến thiên enthalpy chuẩn của phản ứng là: 표 표 표 표 ∆ H298 = 2× ∆ H298 (CO2) + 3×∆ H298 o(H2O) - ∆ H298 (C2H6) = 2×(-393,5) + 3×(-285,8) – (-84,0) = -1560,4 kJ Câu 18. Cho các phát biểu sau: (1) Hầu hết các phản ứng thu nhiệt và tỏa nhiệt đều cần thiết khơi mào (đun hoặc đốt nóng ). (2) Khi đốt cháy tờ giấy hay đốt lò than, ta cần thực hiện giai đoạn khơi mào như đun hoặc đốt nóng. (3) Một số phản ứng thu nhiệt diễn ra bằng cách lấy nhiệt từ môi trường bên ngoài, nên làm cho nhiệt độ của môi trường xung quanh giảm đi. (4) Sau giai đoạn khơi mào, phản ứng tỏa nhiệt cần phải tiếp tục đun hoặc đốt nóng. Trong các phát biểu trên, số phát biểu đúng là A. 1. B. 2.C. 3. D. 4. HD: Phát biểu đúng: (2), (3), (4). Phát biểu (1) không đúng, vì: + Hầu hết các phản ứng thu nhiệt cần thiết khơi mào (đun hoặc đốt nóng ) + Phản ứng tỏa nhiệt có thể có, có thể không cần khơi mào, tùy phản ứng cụ thể. Câu 19. Cho phản ứng sau ở điều kiện chuẩn: 2H2 (g) + O2 (g) 2H2O (g) Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là A. – 506 kJ; B. 428 kJ; C. − 463 kJ; D. 506 kJ. HD: 2H – H (g) + O = O (g) 2H – O – H (g) Biến thiên enthalpy chuẩn của phản ứng là 표 ∆ H298 = 2 x Eb (H2)+ Eb(O2) –2 x Eb(H2O) = 2 x Eb (H-H)+ Eb(O=O) – 2 x 2 x Eb(H-O) = 2x432 + 498 -2x2x467 = - 506 (kJ). Câu 20. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây? A. Tốc độ phản ứng. B. Cân bằng hoá học. C. Phản ứng một chiều. D. Phản ứng thuận nghịch. Câu 21. So sánh tốc độ của 2 phản ứng sau (thực hiện ở cùng nhiệt độ, khối lượng Zn sử dụng là như nhau). Zn (bột) + dung dịch CuSO4 1M (1) Zn (hạt) + dung dịch CuSO4 1M (2) Kết quả thu được là A. (1) nhanh hơn (2). B. (2) nhanh hơn (1). C. như nhau. D. ban đầu như nhau, sau đó (2) nhanh hơn(1). Câu 22. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ phản ứng sẽ lớn nhất khi dùng nhôm ở dạng nào sau đây ? A. Dạng viên nhỏ.B. Dạng bột mịn, khuấy đều. C. Dạng tấm mỏng. D. Dạng nhôm dây. Câu 23. Trong gia đình, nồi áp suất được sử dụng để nấu chín kỹ thức ăn. Lí do nào sau đây không đúng khi giải thích cho việc sử dụng nồi áp suất ? A. Tăng áp suất và nhiệt độ lên thức ăn. B. Giảm hao phí năng lượng. C. Giảm thời gian nấu ăn.D. Tăng diện tích tiếp xúc thức ăn và gia vị. Câu 24. Nước ta, nghề nấu rượu thủ công đã có từ ngàn xửa và hiện nay một số niws đã phát triển thành các làng nghề có tiếng như rượu làng Vân. Rượu được nấu bằng phương pháp lên men. Tinh bột (gạo, ngô, khoai, sắn..) được nấu chín để nguội, sau đó rắc lên một lớp men rồi đem ủ. Sau khoảng 10 – 20 ngày (tùy thời tiết) đem chưng cất thu được rượu. Yếu tố nào đã được sử dụng để tăng tốc độ phản ứng theo cách làm trên? A. Nhiệt độ.B. Xúc tác. C. Nồng độ D. Áp suất. Câu 25: Cho phương trình hóa học của phản ứng: X + 2Y Z + T. Ở thời điểm ban đầu, nồng độ của chất X là 0,01 mol/L. Sau 20 giây, nồng độ của chất X là 0,008 mol/L. Tốc độ trung bình của phản ứng tính theo chất X trong khoảng thời gian trên là A. 4,0.10−4mol/(L.s).B. 1,0.10 −4mol/(L.s). C. 7,5.10−4 mol/(L.s). D. 5,0.10−4 mol/(L.s). C 0,008 0,01 HD: v X 1,0.10 4 (mol/(L.s)) t 20 Câu 26: Cho các phản ứng sau: (a) 2Al(s) + Fe2O3(s) Al2O3(s) + 2Fe(s). (b) 2H2(g) + O2(g) 2H2O(l). (c) C(s) + O2(g) CO2(g). (d) CaCO3(s) + 2HCl(aq) CaCl2(aq) + H2O(l) + CO2(g). Số phản ứng khi tăng áp suất của chất phản ứng, tốc độ bị thay đổi là A. 1. B. 2. C. 3. D. 4. Câu 27: Phản ứng 2NO(g) + O (g) 2NO (g) có biểu thức tốc độ tức thời: v k.C2 .C . 2 2 NO O2 Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ A. giảm 2 lần. B. giảm 4 lần. C. giảm 3 lần. D. giữ nguyên. Câu 28: Cho phương trình hóa học: 2KMnO4(aq) + 10FeSO4(aq) + 8H2SO4(aq) 5Fe2(SO4)3(aq) + K2SO4(aq) + 2MnSO4(aq) + 8H2O(aq) Với cùng một lượng các chất tham gia phản ứng, chất phản ứng hết nhanh nhất là: A. KMnO4. B. FeSO4. C. H2SO4. D. Cả 3 chất hết cùng lúc. II. Phần tự luận: 3 câu Bài 1: Cân bằng phản ứng hóa học bằng phương pháp thăng bằng electron (1,5 điểm) a) NH3 + Br2 -> N2 + HBr b) FeS + HNO3 → Fe(NO3)3 + N2O + H2SO4 + H2O HD: a) Quá trình cho e: −3 2N → N2+3e x 2 Quá trình cho e: Br0→ Br- – 1e Cân bằng: 2NH3 + 3Br2 -> N2 + 6HBr b) Quá trình cho e: Fe+2 → Fe+3 + 1e S-2 → S+6 + 8e Quá trình nhận e: 2N+5 + 8e → 2N+1 Cân bằng: 8FeS + 42HNO3 → 8Fe(NO3)3 + 9N2O + 8H2SO4 + 13H2O Bài 2. Ammonia thường được tổng hợp từ nitrigen và hydrogen bằng quy trình Haber-Bosch: N2(g) + 3H2(g) ↔ 2NH3 (g). 표 a. Tính giá trị ∆ H298 của phản ứng trên từ các giá trị năng lượng liên kết sau: -1 -1 -1 EN ≡ N = 945 kJ mol ; EH-H = 436 kJ mol ; EN-H = 391 kJ mol . b. Tính nhiệt tạo thành tiêu chuẩn của NH3(g). HD: a). Phân tử NH3 có 3 liên kết N-H => 2 phân tử NH3 có 6 liên kết N-H 표 Ta có: ∆ H298 = EN ≡ N + 3x EH-H - 6xEN-H 표 ∆ H298 = 945 + 3x436 – 6x391 = -93kJ 표 표 b. ∆ H298 = 2x∆ H298(NH3) -1 = -46,5 kJ mol . Bài 3: Cho phản ứng: A+ 2B → C Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4 a) Tính tốc độ phản ứng lúc ban đầu. b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l. HD: a) Tốc độ ban đầu: 2 2 Vban đầu = k.[A].[B] = 0,4.[0,3].[0,5] =0,3 mol/ls b) Tốc độ tại thời điểm t Khi nồng độ A giảm 0,1 mol/lít thì B giảm 0,2 mol/l theo phản ứng tỉ lệ 1: 2 Nồng độ tại thời điểm t: [A’] = 0,3 – 0,1 =0,2 (mol/l) [B’]=0,5 -0,2 =0,3 (mol/l) V= k.[A’].[B’] 2= 0,4.[0,2].[0,3] 2=0,0072 mol/ls
File đính kèm:
 de_tham_khao_giua_hoc_ki_ii_hoa_hoc_10_kim_thoa_co_dap_an_ma.docx
de_tham_khao_giua_hoc_ki_ii_hoa_hoc_10_kim_thoa_co_dap_an_ma.docx

