Đề tham khảo kiểm tra học kì 1 Hóa học 10 - Năm học 2022-2023 (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề tham khảo kiểm tra học kì 1 Hóa học 10 - Năm học 2022-2023 (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề tham khảo kiểm tra học kì 1 Hóa học 10 - Năm học 2022-2023 (Có đáp án + Ma trận)
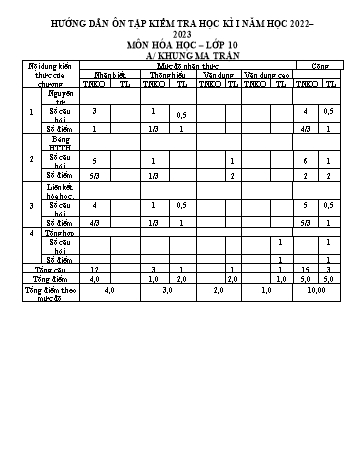
HƯỚNG DẪN ÔN TẬP KIỂM TRA HỌC KÌ I NĂM HỌC 2022– 2023 MÔN HÓA HỌC – LỚP 10 A/ KHUNG MA TRẬN Nội dung kiến Mức độ nhận thức Cộng thức của Nhận biết Thông hiểu Vận dụng Vận dụng cao chương TNKQ TL TNKQ TL TNKQ TL TNKQ TL TNKQ TL Nguyên tử Số câu 3 1 4 0,5 1 0,5 hỏi Số điểm 1 1/3 1 4/3 1 Bảng HTTH Số câu 2 5 1 1 6 1 hỏi Số điểm 5/3 1/3 2 2 2 Liên kết hóa học. 3 Số câu 4 1 0,5 5 0,5 hỏi Số điểm 4/3 1/3 1 5/3 1 4 Tổng hợp Số câu 1 1 hỏi Số điểm 1 1 Tổng câu 12 3 1 1 1 15 3 Tổng điểm 4,0 1,0 2,0 2,0 1,0 5,0 5,0 Tổng điểm theo 4,0 3,0 2,0 1,0 10,00 mức độ ĐỀ THAM KHẢO KIỂM TRA HỌC KÌ 1 – 2022 – 2023 (Theo ma trận TCV) – Đề 1 A. PHẦN TRẮC NGHIỆM (5Đ) Câu 1: Trong nguyên tử, hạt nào có khối lượng không đáng kể so với các hạt còn lại? A. Electron B. neutron C. proton D. proton và electron Câu 2: Cấu hình nào sau đây là của ion Cl- (Z = 17) A. 1s22s22p63s33p5 B. 1s22s22p63s23p6 C. 1s22s22p73s23p5 D. 1s22s22p6 Câu 3: Các liên kết trong phân tử NH3 thuộc liên kết A. cộng hóa trị có cực. C. cộng hóa trị không cực. B. cho nhận. D. ion. Câu 4: Phát biểu nào sau đây không đúng? A. Trong bảng tuần hoàn, fluorine (F) là nguyên tố có độ âm điện lớn nhất. B. Trong một nhóm A, khi điện tích hạt nhân tăng lên thì độ âm điện cũng tăng lên. C. Bán kính nguyên tử của các nguyên tố trong cùng một chu kì giảm từ trái qua phải. D. Độ âm điện đặc trưng cho khả năng hút electron liên kết của một nguyên tử trong phân tử. Câu 5: Chu kì là dãy nguyên tố có cùng A. số lớp electron. B. số electron hóa trị. C. số proton. D. số nơtron. Câu 6: Thí nghiệm tìm ra hạt nhân nguyên tử là? A. Bắn phá hạt nhân nguyên tử nitrogen bằng chùm hạt α B. Dùng hạt α bắn phá hạt nhân nguyên tử Beryllium C. Sự phóng điện cao thể (15kV) trong chân không D. Dùng chùm hạt α bắn phá lá vàng mỏng và dùng màn huỳnh quang theo dõi đường đi của hạt α Câu 7: Số nguyên tố trong chu kì 2 và 4 lần lượt là A. 10 và 18 B. 18 và 8 C. 8 và 8 D. 8 và 18 Câu 8: Phát biểu nào sau đây là đúng khi nói về hình dạng orbital nguyên tử? A. AO s hình số 8 nổi, AO p hình cầu B. AO s hình cầu, AO p hình số tám nổi C. AO s hình vuông, AO p hình cầu D. AO s hình cầu, AO p hình vuông Câu 9: Nguyên tử các nguyên tố nhóm VIIA khi tham gia phản ứng hóa học có khuynh hướng A. nhận 1e B. nhận 2 e C. nhường 1 e D. nhường 7 e Câu 10: Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là A. chu kì 3, nhóm VIIIA B. chu kì 4, nhóm IIA C. chu kì 3, nhóm VIIA D. chu kì 4, nhóm IA Câu 11: Công thức electron nào sau đây không đủ electron theo quy tắc octet? A. B. C. D. Câu 12: Viết phương trình biểu diễn sự hình thành các ion sau đây là đúng? A. Na + 1e Na+ B. Al Al2+ + 2e C. S S2– + 2e D. Ca Ca2+ + 2e 27 Câu 13: Số proton và số nơtron có trong một nguyên tử nhôm ( 13 Al ) lần lượt là A. 13 và 15. B. 12 và 14. C. 13 và 14. D. 13 và 13. Câu 14: Liên kết ion được tạo thành giữa hai nguyên tử bằng A. một hay nhiều cặp electron dùng chung. B. một hay nhiều cặp electron dùng chung chỉ do một nguyên tử đóng góp. C. lực hút tĩnh điện giữa các ion mang điện tích trái dấu. D. một hay nhiều cặp electron dùng chung và các cặp electron này lệch về nguyên tử có độ âm điện lớn hơn. Câu 15 : Cho các nguyên tố 13Al, 14Si, 16S. Tính kim loại của các nguyên tố trên được sắp xếp theo chiều tăng dần như sau : A. Al < Si < S. B. S < Al < Si. C. S < Si < Al. D. Si < S < Al. B. PHẦN TỰ LUẬN (5Đ) 24 Câu 16: (2 điểm)Cho nguyên tử X có ký hiệu 12 X . Nguyên tử của nguyên tố Y có số hạt mang điện ít hơn nguyên tử X là 8 và có số hạt không mang điện bằng 2/3 lần số hạt không mang điện của X. a. Tìm số p,n,e và nêu tính chất cơ bản (KL, PK hay KH) của X và Y? b. X và Y có thể liên kết với nhau tạo thành hợp chất nào? Nêu quá trình tạo thành liên kết trong phân tử hợp chất đó. Câu 17: (2 điểm) a. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH4. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 53,3% về khối lượng. Xác định nguyên tố R ? b. Khi cho 0,8g một kim loại X thuộc nhóm IIA tác dụng với nước thì được 0,4958 lít H2 (250C, 1bar). Tìm kim loại X. Câu 18. (1 điểm) Trong tự nhiên copper có hai đồng vị 63 Cu và 65 Cu tương ứng với tỉ lệ 63 số nguyên tử là 3:1. Tính khối lượng Cu trong 67,25 gam dung dịch CuCl2 20% . ĐÁP ÁN TỰ LUẬN Câu 16: (2đ) 24 a. 12 X : p= e= 12; n= 24-12 = 12 : X là kim loại 2pX - 2pY = 8 => pY = 8; eY = 8; nY = 2/3. nX = 8: Y là phi kim b. X → X2+ + 2e; Y + 2e → Y2- X2+ và Y2- hút nhau bằng lực hút tĩnh điện tạo liên kết ion: X2+ + Y2- →XY Câu 17: (2đ) a. CT oxit cao nhất: RO2 16.2 %O .100% 53,3% => R=28: R là Si R 16.2 b. X + 2H2O →X(OH)2 + H2 n 0,02(mol) M 40 H2 X . Vậy X là Ca Câu 18: (1đ) 63.3 65.1 A 63,5 Cu 3 1 m .C% m dd 13,45(g) CuCl2 100% m 13,45 n 0,1(mol) CuCl2 M 63,5 35,5.2 0,1 n .3 0,075(mol) 63Cu 3 1 m 0,075.63 4,725(g) 63Cu
File đính kèm:
 de_tham_khao_kiem_tra_hoc_ki_1_hoa_hoc_10_nam_hoc_2022_2023.docx
de_tham_khao_kiem_tra_hoc_ki_1_hoa_hoc_10_nam_hoc_2022_2023.docx

