Đề tham khảo ôn tập kiểm tra học kì 1 Hóa học 10 - Đề 6 - Hồng Ân
Bạn đang xem tài liệu "Đề tham khảo ôn tập kiểm tra học kì 1 Hóa học 10 - Đề 6 - Hồng Ân", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề tham khảo ôn tập kiểm tra học kì 1 Hóa học 10 - Đề 6 - Hồng Ân
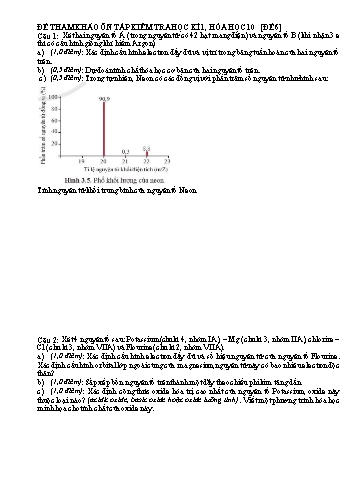
ĐỀ THAM KHẢO ÔN TẬP KIỂM TRA HỌC KÌ 1, HÓA HỌC 10 [ĐỀ 6] Câu 1: Xét hai nguyên tố A (trong nguyên tử có 42 hạt mang điện) và nguyên tố B (khi nhận 3 e thì có cấu hình giống khí hiếm Argon) a) (1,0 điểm): Xác định cấu hình electron đầy đủ và vị trí trong bảng tuần hoàn của hai nguyên tố trên. b) (0,5 điểm): Dự đoán tính chất hóa học cơ bản của hai nguyên tố trên. c) (0,5 điểm): Trong tự nhiên, Neon có các đồng vị với phần trăm số nguyên tử như hình sau: Tính nguyên tử khối trung bình của nguyên tố Neon Câu 2: Xét 4 nguyên tố sau: Potassium(chu kì 4, nhóm IA), – Mg (chu kì 3, nhóm IIA), chlorine – Cl (chu kì 3, nhóm VIIA) và Flourine (chu kì 2, nhóm VIIA). a) (1,0 điểm): Xác định cấu hình electron đầy đủ và số hiệu nguyên tử của nguyên tố Flourine. Xác định cấu hình orbital lớp ngoài cùng của magnesium, nguyên tử này có bao nhiêu electron độc thân? b) (1,0 điểm): Sắp xếp bốn nguyên tố trên thành một dãy theo chiều phi kim tăng dần c) (1,0 điểm): Xác định công thức oxide hóa trị cao nhất của nguyên tố Potassium, oxide này thuộc loại nào? (acidic oxide, basic oxide hoặc oxide lưỡng tính). Viết một phương trình hóa học minh họa cho tính chất của oxide này. Câu 3: . Trong oxide cao nhất của nguyên tố R thuộc nhóm VIA, có chứa 60% khối lượng oxygen. (a) (1,0 điểm): Xác định R? (b) (1,0 điểm): Cho 16 gam oxide cao nhất của R phản ứng hết với 50 gam dung dịch NaOH a% tạo muối trung hòa. Biết rằng NaOH dùng dư 20% so với lượng vừa đủ. Tính a. Câu 4: Xét các nguyên tố hóa học sau: H (Z=1), Cl(Z=17), C (Z=6) và Ba (Z=56). a) (1,0 điểm): Mô tả sự hình thành liên kết ion trong hợp chất giữa Ba và Cl b) (1,0 điểm): Đề xuất công thức electron và công thức cấu tạo phù hợp với phân tử Cl2 và C2H6. Câu 5. Cho các chất sau: C2H6, H2S, H2O, CH3OH, CH3COOH, CH3NH2. xác định số liên kết và liên kết trong từng phân tử
File đính kèm:
 de_tham_khao_on_tap_kiem_tra_hoc_ki_1_hoa_hoc_10_de_6_hong_a.docx
de_tham_khao_on_tap_kiem_tra_hoc_ki_1_hoa_hoc_10_de_6_hong_a.docx

