Giáo án Hóa học Khối 9 - Chương trình cả năm
I. Mục tiêu:
1) Kiến thức:
- Nêu được những tính chất hoá học của oxit (bazơ và axit) ; dẫn ra được PTHH minh hoạ cho mỗi tính chất
+ Oxit bazơ tác dụng với nước, dd axit, oxit axit
+ Oxit axit tác dụng với nước, dd bazơ, oxit bazơ
Phân loại oxit ( Oxit axit, oxit bazơ, oxit lưỡng tính và oxit trung tính)
2) Kỹ năng:
- Quan sát thí nghiệm, rút ra tính chất hóa học
- Dự đoán, kiếm tra và kết luận về tính chất hóa học của oxit
- Viết các phương trình phản ứng minh họa
- Phân biệt một số oxit cụ thể
- Tính thành phần % về khối lượng của oxit trong hỗn hợp 2 chất
II. Chuẩn bị:
1) Giáo viên :
- Hoá chất: CuO, CaO, nước cất, dd HCl.
- Dụng cụ: 1 kh. nhựa, 1 giá ốn., 1 kẹp gỗ, 1 cốc t.tinh 50 ml, 1 ố.n.giọt, 4 ống nghiệm.
2) Học sinh : Ôn lại khái niệm về oxit, phân loại, cách gọi tên.
III. Phương pháp: Trực quan + Đàm thoại + Thuyết trình
IV. Tiến trình dạy học:
Tóm tắt nội dung tài liệu: Giáo án Hóa học Khối 9 - Chương trình cả năm
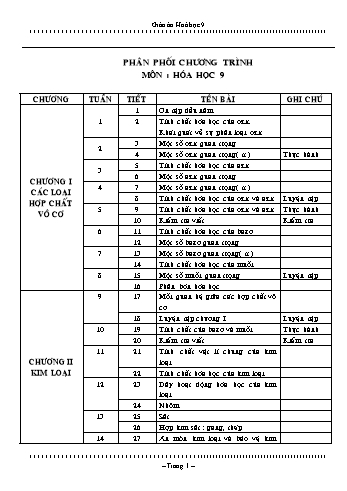
chaát vaät lí chung cuûa kim loaïi 22 Tính chaát hoùa hoïc cuûa kim loaïi 12 23 Daõy hoaït ñoäng hoùa hoïc cuûa kim loaïi 24 Nhoâm 13 25 Saét 26 Hôïp kim saét : gang, theùp 14 27 Aên moøn kim loaïi vaø baûo veä kim loaïi khoâng bò aên moøn 28 Luyeän taäp chöông II Luyeän taäp 15 29 Tính chaát hoùa hoïc cuûa nhoâm vaø saét Thöïc haønh CHÖÔNG III PHI KIM SÔ LÖÔÏC BAÛNG TUAÀN HOAØN CAÙC NGUYEÂN TOÁ HOÙA HOÏC 30 Tính chaát chung cuûa phi kim 16 31 Clo 32 Clo( tt ) 17 33 Cacbon 34 Caùc oxit cacbon Luyeän taäp 18 35 Oân taäp hoïc kì I Oân taäp 19 36 Kieåm tra hoïc kì I Kieåm tra 20 37 Axit cacbonic vaø muoái cacbonat 38 Silic. Coâng nghieäp silicat 21 39 Sô löôïc baûng heä thoáng tuaàn hoaøn caùc nguyeân toá hoùa hoïc 40 Sô löôïc baûng heä thoáng tuaàn hoaøn caùc nguyeân toá hoùa hoïc ( tt ) 22 41 Luyeän taäp chöông III Luyeän taäp 42 Tính chaát hoùa hoïc cuûa phi kim vaø hôïp chaát cuûa chuùng Thöïc haønh CHÖÔNG IV HIÑR...ch tính theo PTHH . Thuyết trình : axit – bazơ – muối , học sinh nên ôn lại về: thành phần phân tử, phân loại, gọi tên. Thế nào là dung dịch ? Độ tan của 1 chất trong nước là như thế nào ? Thế nào là nồng độ phần trăm ; nồng độ dung dịch ? Bổ sung, hoàn chỉnh nội dung. Đại diện phát biểu, bổ sung: Đại diện nêu các công thức chuyển đổi. Nghe, quan sát và ghi nhớ nội dung giáo viên thuyết trình. Học sinh về ôn lại nội dung theo hướng dẫn . Đại diện phát biểu, bổ sung: khái niệm dung dịch, độ tan. Đại diện nêu khái niệm C%, CM . I. Kiến thức cần nhớ: Công thức chuyển đổi: giữa khối lượng (m), thể tích (v) và lượng chất - số mol (n) m = m / M ; nkhí = V / 22,4 Tính theo PTHH : tìm k.lượng hoặc t.tích ch.th.gia bằng cách : chuyển đổi về số mol rồi thế vào PTHH ; suy ra số chất cần tìm rồi chuyển về khối lượng hoặc thể tích đề bài yêu cầu . Axit – bazơ – muối. Dung dịch , độ tan. Nồng độ dung dịch : + N.độ p.trăm của d. dịch : C% = mct x 100 / mdd + N.độ mol của dung dịch : CM = n / v II. Bài tập áp dụng : Hãy gọi tên và phân loại các hợp chất sau : Na2O, CaO, HCl, H2SO4, H2SO3, NaOH, Fe(OH)3, NaCl, CaSO4 Cho 6,5 g kẽm tác dụng với dung dịch axit clodric. Tính khối lượng kẽm clorua tạo thành và thể tích khí Hidro sinh ra (ở đktc) ? Hãy tính : Nồng độ mol của 850 ml dung dịch có hoà tan 20 g KNO3 ? Nồng độ phần trăm của 1500 g dung dịch có hoà tan 75 g K2SO4 ? Số mol và số g của NaCl có trong 1 lit dung dịch NaCl 0,5 M ? Khối lượng của MgCl2 có trong 50 g dung dịch MgCl2 4% ? Dặn dò: Ôn lại các khái niệm hoá học ở học kì 1 của lớp 8 Học sinh nên ôn lại về: thành phần phân tử, phân loại, gọi tên của oxit . VI. Rút kinh nghiệm ............................................................................................................................................................................................................................................................................................. G.thiệu: o.axit t.d.với o.bazơ tạo thành muối vừa tìm hiểu ở mục 1c. Th.trình về sự phân loại oxit: là dựa vào tchh của oxit, p.thành 4 loại Y/c h/s lấy Vd, với oxit axit và oxit bazơ. Mở rộng: o.lưỡng tính Al2O3 td. với HCl, NaOH 2NaOH + Al2O3 ® 2NaAlO2 + 3H2O Natri aluminat 6HCl + Al2O3 ® 3AlCl3 + 3H2O Kẻ tập thành 2 cột . Quan sát thí nghiệm, Đại diện nhận xét hiện tượng quan sát được. Q.sát t.n . Đ.diện n.xét m.sắc CuO trướcvà sau pư. Nghe thuyết trình về tính chất oxit bazơ tác dụng với oxit axit. Đại diện phát biểu, bổ sung. Nghe nhắc lại pứ với nước vôi trong của nước vôi trong. Nghe giáo viên giới thiệu. Nghe giáo viên thông báo về sự phân loại oxit. Đại diện nêu ví dụ minh hoạ. Đặc điểm của oxit lưỡng tính. I. Tính chất hoá học của oxit: 1. Oxit bazơ có những tính chất hoá học nào? Tác dụng với nước: CaO (r) + H2O(l) ® Ca(OH)2(dd) Na2O (r) + H2O(l) ® 2NaOH2(dd) Oxit bazơ tan + H2O ® dd bazơ (kiềm) Vd: K2O, Li2O, Na2O, BaO, Tác dụng với axit: CuO(r) + HCl(dd) ® CuCl2(dd) + H2O(l) Đen xanh lá cây Oxit bazơ + axit ® muối + nước. T.dụng với oxit axit: BaO(r) + CO2(k) ® BaCO3(r) CaO(r) + SO2(k) ® CaSO3(r) Oxit bazơ tan + oxit axit ® muối 2.Oxit axit có những tính chất hoá học nào? Tác dụng với nước: Oxit axit + nước ® dd axit Trừ SiO2 . Vd: P2O5, CO2, SO2, N2O5, P2O5(r) + 3H2O(l) ® 2H3PO4(dd) SO2(r) + H2O(l) ® H2SO3(dd) T.dụng với bazơ : Oxit axit + dd bazơ ® muối + nước CO2(k) + Ca(OH)2(dd) ® CaCO3(r) + H2O(l) T.dụng với o.bazơ: o.axit t.dụng với một số o.bazơ tạo thành muối . (1.c) II. Khái quát về sự phân loại oxit: dựa vào tính chất hoá học chia thành 4 loại: Oxit bazơ: tác dụng được với dung dịch axit tạo thành muối và nước: Na2O Oxit axit: t.dụng được với dd.bazơ tạo thành muối: CO2, SO2 Oxit lưỡng tính: tác dụng được với cả d.dịch axit và bazơ: Al2O3, ZnO. Oxit trung tính (oxit không tạo muối): k.t.dụng được với cả dd. axit hoặc dung dịch bazơ:
File đính kèm:
 giao_an_hoa_hoc_khoi_9_chuong_trinh_ca_nam.doc
giao_an_hoa_hoc_khoi_9_chuong_trinh_ca_nam.doc

