Ma trận và bảng đặc tả đề kiểm tra cuối kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Cao Phong
Bạn đang xem tài liệu "Ma trận và bảng đặc tả đề kiểm tra cuối kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Cao Phong", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Ma trận và bảng đặc tả đề kiểm tra cuối kì II Hóa học 10 - Năm học 2022-2023 - Trường THPT Cao Phong
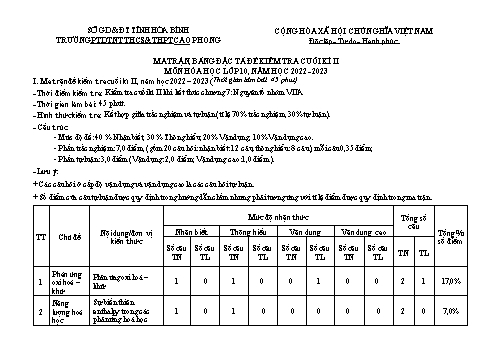
SỞ GD & ĐT TỈNH HÒA BÌNH CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM TRƯỜNG PTDTNT THCS&THPT CAO PHONG Độc lập- Tự do- Hạnh phúc MA TRẬN, BẢNG ĐẶC TẢ ĐỀ KIỂM TRA CUỐI KÌ II MÔN HÓA HỌC LỚP 10, NĂM HỌC 2022 - 2023 I. Ma trận đề kiểm tra cuối kì II, năm học 2022 – 2023 (Thời gian làm bài: 45 phút) - Thời điểm kiểm tra: Kiểm tra cuối kì II khi kết thúc chương 7: Nguyên tố nhóm VIIA - Thời gian làm bài: 45 phút. - Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận). - Cấu trúc: - Mức độ đề: 40 % Nhận biết; 30 % Thông hiểu; 20% Vận dụng; 10% Vận dụng cao. - Phần trắc nghiệm: 7,0 điểm, (gồm 20 câu hỏi: nhận biết: 12 câu, thông hiểu: 8 câu), mỗi câu 0,35 điểm; - Phần tự luận: 3,0 điểm (Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm). - Lưu ý: + Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận. + Số điểm của câu tự luận được quy định trong hướng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận. Mức độ nhận thức Tổng số câu Nội dung/đơn vị Nhận biết Thông hiểu Vận dụng Vận dụng cao Tổng % TT Chủ đề kiến thức số điểm Số câu Số câu Số câu Số câu Số câu Số câu Số câu Số câu TN TL TN TL TN TL TN TL TN TL Phản ứng Phản ứng oxi hoá – 1 oxi hoá – 1 0 1 0 0 1 0 0 2 1 17,0% khử khử Năng Sự biến thiên 2 lượng hoá enthalpy trong các 1 0 1 0 0 0 0 0 2 0 7,0% học phản ứng hoá học Mức độ nhận thức Tổng số câu Nội dung/đơn vị Nhận biết Thông hiểu Vận dụng Vận dụng cao Tổng % TT Chủ đề kiến thức số điểm Số câu Số câu Số câu Số câu Số câu Số câu Số câu Số câu TN TL TN TL TN TL TN TL TN TL 1. Phương trình tốc độ phản ứng và hằng 2 0 0 0 0 0 0 0 2 Tốc độ số tốc độ của phản 3 phản ứng ứng 1 34, 5% hoá học 2. Các yếu tố ảnh hưởng tới tốc độ phản 3 0 2 0 0 0 0 1 5 ứng Nguyên tố 1. Nhóm halogen 3 0 2 0 0 0 0 0 5 4 nhóm 1 41, 5% 2.Hydrogen halide. VIIA 2 0 2 0 0 1 0 0 4 Muối halide Tổng 12 8 0 2 1 20 3 Tỉ lệ % số điểm 40% 30% 20% 10% 100% II. Bảng đặc tả đề kiểm tra cuối kì II, năm học 2022-2023 Số câu hỏi theo các mức độ Nội nhận thức dung Đơn vị TT Yêu cầu cần đạt Vận Tổng kiến kiến thức Nhận Thông Vận dụng thức biết hiểu dụng cao 1 Phản Phản ứng Nhận biết: ứng oxi oxi hoá – – Nêu được khái niệm số oxi hoá của nguyên tử các nguyên tố trong hợp hoá – khử chất. khử – Nêu được khái niệm về phản ứng oxi hoá – khử và ý nghĩa của phản ứng oxi hoá – khử. Thông hiểu: 1 1 1 0 3 Xác định được số oxi hoá của nguyên tử các nguyên tố trong hợp chất. Vận dụng: – Mô tả được một số phản ứng oxi hoá – khử quan trọng gắn liền với cuộc sống. – Cân bằng được phản ứng oxi hoá – khử bằng phương pháp thăng bằng electron. 2 Năng Sự biến Nhận biết: lượng thiên – Trình bày được khái niệm phản ứng toả nhiệt, thu nhiệt; điều hoá học enthalpy kiện chuẩn (áp suất 1 bar và thường chọn nhiệt độ 25oC hay 298 trong các K); phản ứng - Trình bày được khái niệm enthalpy tạo thành (nhiệt tạo thành) 1 1 0 0 2 hoá học o f H298, biến thiên enthalpy (nhiệt phản ứng) của phản ứng o rH298. Thông hiểu: o - Nêu được ý nghĩa của dấu và giá trị rH298. 3 Tốc độ 1. Phương Nhận biết: phản trình tốc độ – Trình bày được khái niệm tốc độ phản ứng hoá học. ứng phản ứng Thông hiểu: hoá học và hằng số – Trình bày được cách tính tốc độ trung bình của phản ứng. tốc độ của 2 0 0 0 2 phản ứng – Viết được biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ (còn gọi là định luật tác dụng khối lượng (M. Guldberg và P. Waage, 1864) chỉ đúng cho phản ứng đơn giản nên không tùy ý áp dụng cho mọi phản ứng). 2. Các yếu Nhận biết: tố ảnh Nêu được ý nghĩa của hệ số nhiệt độ Van’t Hoff (γ). hưởng tới Thông hiểu: tốc độ phản Giải thích được các yếu tố ảnh hưởng tới tốc độ phản ứng như: ứng nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. 3 2 0 1 6 Vận dụng cao: Vận dụng được kiến thức tốc độ phản ứng hoá học vào việc giải thích một số vấn đề trong cuộc sống và sản xuất và làm các bài tập liên quan. 4 Nguyên 1. Nhóm Nhận biết: tố halogen – Phát biểu được trạng thái tự nhiên của các nguyên tố halogen. nhóm Thông hiểu: VIIA – Mô tả được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. 3 2 0 0 5 – Giải thích được sự biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen dựa vào tương tác van der Waals. – Trình bày được xu hướng nhận thêm 1 electron (từ kim loại) hoặc dùng chung electron (với phi kim) để tạo hợp chất ion hoặc hợp chất cộng hoá trị dựa theo cấu hình electron. – Giải thích được xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của halogen và năng lượng liên kết H–X (điều kiện phản ứng, hiện tượng phản ứng và hỗn hợp chất có trong bình phản ứng). – Viết được phương trình hoá học của phản ứng tự oxi hoá – khử của chlorine trong phản ứng với dung dịch sodium hydroxide ở nhiệt độ thường và khi đun nóng. 2.Hydrogen Nhận biết: halide. - Từ bảng dữ liệu về nhiệt độ sôi giải thích được xu hướng biến đổi Muối nhiệt độ sôi của các hydrogen halide từ HCl tới HI dựa vào tương halide tác Va der Waals. - Giải thích được sự bất thường về nhiệt độ sôi cảu HF so với các HX khác. Thông hiểu: - Trình bày được xu hướng biến đổi tính acid của dãy hydrohalic 2 2 1 0 5 acid - Trình bày được tính khử của các ion halide thông qua phản ứng với chất oxi hóa là sulfuric acid đặc. - Nêu được ứng dụng của một số muối hydrogen halide. Vận dụng – Làm được các bài tập tính toán liên quan đến muối hydrogen halide. Tổng 12 8 2 1 Tỉ lệ % từng mức độ 40% 30% 20% 10% 100% nhận thức Tỉ lệ chung 70% 30% 100%
File đính kèm:
 ma_tran_va_bang_dac_ta_de_kiem_tra_cuoi_ki_ii_hoa_hoc_10_nam.doc
ma_tran_va_bang_dac_ta_de_kiem_tra_cuoi_ki_ii_hoa_hoc_10_nam.doc

