Ma trận và đặc tả đề kiểm tra cuối kì 1 Hóa học 10
Bạn đang xem tài liệu "Ma trận và đặc tả đề kiểm tra cuối kì 1 Hóa học 10", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Ma trận và đặc tả đề kiểm tra cuối kì 1 Hóa học 10
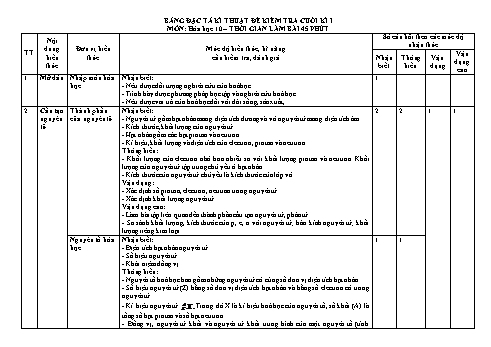
BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA CUỐI KÌ I MÔN: Hóa học 10 – THỜI GIAN LÀM BÀI 45 PHÚT Số câu hỏi theo các mức độ Nội nhận thức dung Đơn vị kiến Mức độ kiến thức, kĩ năng TT Vận kiến thức cần kiểm tra, đánh giá Nhận Thông Vận dụng thức biết hiểu dụng cao 1 Mở đầu Nhập môn hóa Nhận biết: 1 học - Nêu được đối tượng nghiên cứu của hoá học. - Trình bày được phương pháp học tập và nghiên cứu hoá học. - Nêu được vai trò của hoá học đối với đời sống, sản xuất,... 2 Cấu tạo Thành phần Nhận biết: 2 2 1 1 nguyên của nguyên tử - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử mang điện tích âm. tử - Kích thước, khối lượng của nguyên tử. - Hạt nhân gồm các hạt proton và neutron. - Kí hiệu, khối lượng và điện tích của electron, proton và neutron. Thông hiểu: - Khối lượng của electron nhỏ hơn nhiều so với khối lượng proton và neutron. Khối lượng của nguyên tử tập trung chủ yếu ở hạt nhân. - Kích thước của nguyên tử chủ yếu là kích thước của lớp vỏ. Vận dụng: - Xác định số proton, electron, neutron trong nguyên tử. - Xác định khối lượng nguyên tử. Vận dụng cao: - Làm bài tập liên quan đến thành phần cấu tạo nguyên tử, phân tử. - So sánh khối lượng, kích thước của p, e, n với nguyên tử; bán kính nguyên tử; khối lượng riêng kim loại. Nguyên tố hóa Nhận biết: 1 1 học - Điện tích hạt nhân nguyên tử. - Số hiệu nguyên tử. - Khái niệm đồng vị. Thông hiểu: - Nguyên tố hoá học bao gồm những nguyên tử có cùng số đơn vị điện tích hạt nhân. - Số hiệu nguyên tử (Z) bằng số đơn vị điện tích hạt nhân và bằng số electron có trong nguyên tử. A - Kí hiệu nguyên tử Z X. Trong đó X là kí hiệu hoá học của nguyên tố, số khối (A) là tổng số hạt proton và số hạt neutron. - Đồng vị, nguyên tử khối và nguyên tử khối trung bình của một nguyên tố (tính nguyên tử khối trung bình của nguyên tố có hai đồng vị khi biết phần trăm số nguyên tử mỗi đồng vị). Vận dụng: - Xác định số electron, số proton, số neutron, số khối, điện tích hạt nhân khi biết kí hiệu nguyên tử và ngược lại. - Tính nguyên tử khối trung bình của nguyên tố có nhiều đồng vị. - Dựa vào phổ khối lượng, đọc thông tin về các đồng vị, hoặc tính toán nguyên tử khối trung bình từ phổ khối (áp dụng cho 2 đồng vị) Vận dụng cao: - Tính phần trăm số nguyên tử các đồng vị khi biết NTK trung bình và các số khối (áp dụng cho 2-3 đồng vị). - Tính số nguyên tử, phần trăm khối lượng của một đồng vị trong một lượng chất xác định. - Tính nguyên tử khối trung bình trong bài toán phức tạp. Cấu trúc lớp Nhận biết: 2 2 vỏ electron của - Trình bày và so sánh được mô hình của Rutherford - Bohr với mô hình hiện đại mô tả nguyên tử sự chuyển động của electron trong nguyên tử. - Các electron chuyển động rất nhanh xung quanh hạt nhân nguyên tử không theo những quỹ đạo xác định, tạo nên vỏ nguyên tử. - Nêu được khái niệm về orbital nguyên tử (AO), mô tả được hình dạng của AO (s, p), số lượng electron trong 1 AO. - Trong nguyên tử, các electron có mức năng lượng gần bằng nhau được xếp vào một lớp (K, L, M, N). Liên hệ được về số lượng AO trong một phân lớp, trong một lớp. - Một lớp electron bao gồm một hay nhiều phân lớp. - Các electron trong mỗi phân lớp có mức năng lượng bằng nhau. - Số electron tối đa trong một lớp, một phân lớp, AO. - Thứ tự các mức năng lượng của các electron trong nguyên tử. - Đặc điểm của lớp electron ngoài cùng: Lớp ngoài cùng có nhiều nhất là 8 electron (ns2np6), lớp ngoài cùng của nguyên tử khí hiếm có 8 electron (riêng helium có 2 electron). - Hầu hết các nguyên tử kim loại có 1, 2, 3 electron ở lớp ngoài cùng. - Hầu hết các nguyên tử phi kim có 5, 6, 7 electron ở lớp ngoài cùng. Thông hiểu: - Ở trạng thái cơ bản, trong nguyên tử các electron lần lượt chiếm các mức năng lượng từ thấp đến cao và sắp xếp thành từng lớp. (Thứ tự các mức năng lượng) - Nguyên lí vững bền của Pauli - Quy tắc Hund. - Hiểu được cách phân bố electron vào các lớp thứ 1, 2, 3. - Hiểu được cách phân bố electron vào các phân lớp. - Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuần hoàn. - Quy ước viết cấu hình electron của nguyên tử. - Xác định số electron lớp ngoài cùng. - Xác định loại nguyên tố s, p, d dựa vào cấu hình electron nguyên tử. Vận dụng: - Xác định được thứ tự các lớp electron trong nguyên tử, số phân lớp (s, p, d) trong một lớp, trong nguyên tử và biểu diễn được sự phân bố các electron trên mỗi lớp trong nguyên tử cụ thể. - Viết được cấu hình electron nguyên tử của một số nguyên tố hoá học. - Sự phân bố electron trên các phân lớp, lớp và cấu hình electron nguyên tử của 20 nguyên tố đầu tiên. - Dựa vào cấu hình electron lớp ngoài cùng của nguyên tử suy ra tính chất hoá học cơ bản (là kim loại, phi kim hay khí hiếm) của nguyên tố tương ứng. 3 Bảng Cấu tạo bảng Nhận biết: 1 1 tuần tuần hoàn các - Nêu được về lịch sử phát minh định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoàn nguyên tố hóa hoá học. các học - Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn (dựa theo cấu hình electron). nguyên - Cấu tạo của bảng tuần hoàn: ô, chu kì, nhóm nguyên tố (nhóm A, nhóm B). tố hóa Thông hiểu: học - Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hoá học và nêu được các khái niệm liên quan (ô, chu kì, nhóm): + Chu kì: là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. + Nhóm gồm các nguyên tố mà nguyên tử của chúng có số e hóa trị bằng nhau và bằng số thứ tự của nhóm. - Mối liên hệ giữa cấu hình electron và vị trí nguyên tố trong bảng tuần hoàn. - Số thứ tự ô nguyên tố bằng = số p = số e Vận dụng: - Xác định vị trí của nguyên tố khi biết cấu hình electron nguyên tử và ngược lại viết cấu hình electron, dự đoán tính chất dựa vào vị trí trong bảng tuần hoàn. - Giải thích được mối liên hệ giữa cấu hình electron và vị trí của nguyên tố trong bảng tuần hoàn, dẫn ra thí dụ minh họa. - Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hoá học: kim loại, phi kim, khí hiếm). Vận dụng cao: - Làm bài tập xác định vị trí của một nguyên tố; hoặc 2 nguyên tố ở 2 chu kỳ liên tiếp (thuộc cùng 1 nhóm A ở các chu kỳ nhỏ), hoặc 2 nguyên tố ở 2 nhóm A liên tiếp của 1 chu kỳ. Xu hướng biến Nhận biết: 1 1 đổi một số tính - Đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A. chất của - Biết được sự biến đổi bán kính nguyên tử của các nguyên tố nhóm A. nguyên tử các - Biết được sự biến đổi độ âm điện của các nguyên tố nhóm A. nguyên tố, - Biết được sự biến đổi tính kim loại, phi kim của các nguyên tố nhóm A. thành phần và - Biết được sự biến đổi tính acid - base của các oxide và hyđroxide tương ứng theo chu một số tính kì. chất của hợp - Biết hoá trị cao nhất với oxigen và hoá trị với hydrogen. chất trong một Thông hiểu chu kì và - Sự biến đổi tuần hoàn cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm. khi số điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. - Quy luật biến đổi độ âm điện của các nguyên tố nhóm A. - Quy luật biến đổi tính kim loại, tính phi kim các nguyên tố nhóm A. - Sự biến đổi hoá trị cao nhất với oxigen và hoá trị với hydrogen các nguyên tố trong một chu kì. Vận dụng: - Dựa vào cấu hình electron của nguyên tử, suy ra cấu tạo nguyên tử, đặc điểm cấu hình electron lớp ngoài cùng, dự đoán được tính chất của các nguyên tố và một số hợp chất. - Dựa vào qui luật chung, suy đoán được sự biến thiên trong chu kì (các nguyên tố nhóm A) và trong nhóm A cụ thể về: ▪ Độ âm điện, bán kính nguyên tử. ▪ Hoá trị cao nhất với oxigen và hoá trị với hydrogen ▪ Tính chất kim loại, phi kim. ▪ Tính tính acid - base của các oxide và hyđroxide tương ứng. Vận dụng cao: - Làm bài tập liên quan đến oxide cao nhất, hyđroxide, hợp chất khí với hiđrogen. - So sánh tính chất hóa học của các nguyên tố và một số hợp chất tương ứng. Định luật tuần Nhận biết 1 1 hoàn - Ý nghĩa – Phát biểu được định luật tuần hoàn. của bảng tuần Thông hiểu hoàn các Trình bày được ý nghĩa của bảng tuần hoàn các nguyên tố hoá học: Mối liên hệ giữa vị nguyên tố hóa trí (trong bảng tuần hoàn các nguyên tố hoá học) với tính chất và ngược lại. học 4 Nhận biết: 3 2 1 1 Quy tắc octet - Nội dung quy tắc octet. Liên kết ion - Định nghĩa liên kết ion. - Biết được ion, cation, anion. - Biết được ion đơn nguyên tử, ion đa nguyên tử. Thông hiểu: - Sự tạo thành ion ( cation, anion). - Ion đơn nguyên tử, ion đa nguyên tử. - Hiểu được cấu hình electron của ion đơn nguyên tử. - Hiểu được cấu tạo tinh thể NaCl. Vận dụng: - Viết được cấu hình electron của ion đơn nguyên tử cụ thể. - Xác định ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ thể. - Vận dụng quy tắc octet trong sự hình thành một số phân tử đơn giản. - Trình bày sự hình thành liên kết ion của một số phân tử đơn giản, Liên kết cộng Nhận biết: 4 2 hóa trị - Định nghĩa liên kết cộng hoá trị, liên kết cộng hoá trị không phân cực (H 2, O2), liên kết cộng hoá trị phân cực (HCl, CO 2). Mối liên hệ giữa hiệu độ âm điện của 2 nguyên tố và bản chất liên kết hoá học giữa 2 nguyên tố đó trong hợp chất. - Tính chất chung của các chất có liên kết cộng hoá trị. - Khái niệm về liên kết cho nhận. - Khái niệm năng lượng liên kết. Thông hiểu: - Dự đoán được kiểu liên kết hoá học có thể có trong phân tử gồm 2 nguyên tử khi biết hiệu độ âm điện của chúng. - Quan hệ giữa liên kết cộng hoá trị không phân cực, liên kết cộng hoá trị phân cực và liên kết ion. - Phân biệt được các loại liên kết. - Sự hình thành liên kết 흈 và 흅. Vận dụng: - Viết được công thức electron, công thức Lewis và công thức cấu tạo của một số phân tử đơn giản. - So sánh độ bền liên kết giữa các chất dựa vào năng lượng liên kết hoặc độ dài liên kết. Vận dụng cao: - Vận dụng kiến thức về liên kết hóa học giải thích tính chất của một số chất có liên kết cộng hóa trị. - Dự đoán liên kết, viết công thức electron, công thức Lewis và công thức cấu tạo của một số phân tử. - Giải thích sự hình thành liên kết 흈 và 흅 của một số phân tử đơn giản qua sự xen phủ AO. Tổng 16 12 2 2 MA TRẬN ĐỀ KIỂM TRA CUỐI KÌ 1 MÔN: Hóa học 10 – THỜI GIAN LÀM BÀI: 45 phút Mức độ nhận thức Tổng % Nội dung kiến Vận dụng TT Đơn vị kiến thức Nhận biết Thông hiểu Vận dụng tổng thức cao Số CH điểm Số Số Số Số Điểm Điểm Điểm Điểm Điểm TN TL CH CH CH CH 1 Mở đầu Nhập môn hóa học 1 0.25 0 0 1 0.25 2,50% Thành phần của nguyên tử 2 0.5 2 0.5 1 1 1 0.5 4 1,5 2,0 20.0% 2 Cấu tạo nguyên Nguyên tố hóa học 1 0.25 1 0.25 2 0,5 5.0% tử Cấu trúc lớp vỏ electron nguyên tử 2 0.5 2 0,5 4 1.5 15,0% Cấu tạo bảng tuần hoàn các nguyên tố hóa học 1 0.25 1 0.25 2 0,5 5.0% Bảng tuần hoàn Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và 3 các nguyên tố 1 0.25 1 0.25 2 0,5 5.0% hoá học một số tính chất của hợp chất trong một chu kì và nhóm Định luật tuần hoàn - Ý nghĩa của bảng 1 0.25 1 0.25 2 0.5 5.0% tuần hoàn các nguyên tố hóa học Quy tắc octet 1 1 1 0,5 1,5 Liên kết hóa 3 0,75 2 0,5 5 2,25 22,5 4 Liên kết ion học Liên kết cộng hóa trị 4 1,0 2 0,5 6 2,0 20,0 Tổng 16 4 12 3 2 2 2 1 28 4 10 100% Tỉ lệ % 40% 30% 20% 10% Tỉ lệ chung 70% 30% Lưu ý: - Các câu hỏi ở cấp độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng. - Các câu hỏi ở cấp độ vận dụng và vận dụng cao là các câu hỏi tự luận. - Số điểm tính cho 1 câu trắc nghiệm là 0,25 điểm. Số điểm của câu tự luận được quy định trong hưỡng dẫn chấm nhưng phải tương ứng với tỉ lệ điểm được quy định trong ma trận. - Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng, trong đó 1 câu ở đơn vị kiến thức thành phần của nguyên tử hoặc nguyên tố hóa học, hoặc cấu trúc lớp vỏ electron của nguyên tử hoặc cấu tạo BTH các nguyên tố hóa học hoặc xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm. 1 cấu ở đơn vị kiến thức quy tắc octet hoặc liên kết ion hoặc liên kết cộng hóa trị. - Giáo viên ra 2 câu hỏi cho đề kiểm tra ở cấp độ vận dụng cao, trong đó 1 câu ở đơn vị kiến thức thành phần của nguyên tử hoặc nguyên tố hóa học hoặc cấu tạo BTH các nguyên tố hóa học hoặc xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong một chu kì và nhóm. 1 cấu ở đơn vị kiến thức liên kết cộng hóa trị. - Không được chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
File đính kèm:
 ma_tran_va_dac_ta_de_kiem_tra_cuoi_ki_1_hoa_hoc_10.docx
ma_tran_va_dac_ta_de_kiem_tra_cuoi_ki_1_hoa_hoc_10.docx

